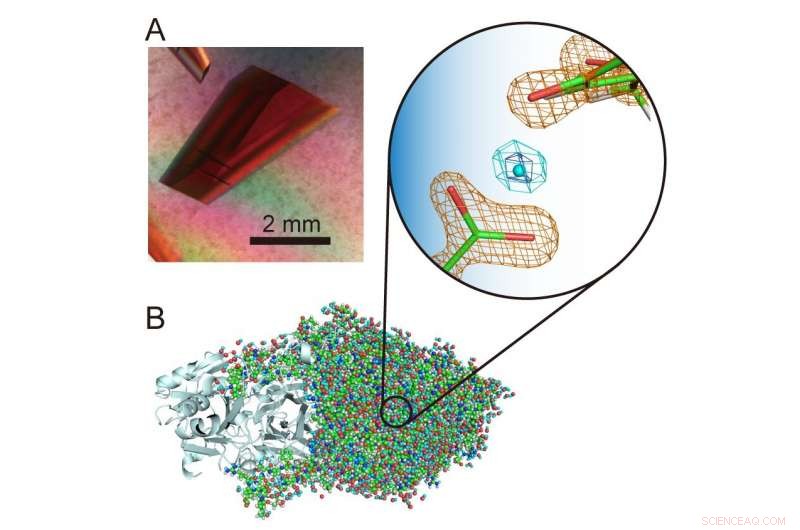
(A) Cristallo extra-large di un'ammina ossidasi di rame. (B) Struttura tridimensionale dell'ammina ossidasi di rame inclusi gli atomi di idrogeno. Un insolito protone "levitato" è presentato al centro della vista ingrandita. Credito:Università di Osaka
Comprendere il comportamento di proteine ed enzimi è la chiave per svelare i segreti dei processi biologici. Le strutture atomiche delle proteine sono generalmente studiate mediante cristallografia a raggi X; però, le informazioni precise per atomi di idrogeno e protoni (ioni di idrogeno) sono solitamente irraggiungibili. Ora un team che include l'Università di Osaka, Istituto Superiore di Medicina di Osaka, Istituti Nazionali per la Scienza e la Tecnologia Quantistica e Radiologica, Università di Ibaraki, e l'Università di Tsukuba ha utilizzato la cristallografia neutronica per rivelare dettagli strutturali ad alta risoluzione di una proteina ossidasi molto grande. I loro risultati sono pubblicati in PNAS .
Gli atomi di idrogeno ei protoni che costituiscono circa la metà degli atomi nelle proteine e negli enzimi svolgono spesso ruoli cruciali nei lavori svolti da queste biomolecole; però, le loro posizioni esatte sono difficili da individuare a causa delle loro piccole dimensioni. L'approccio più comune per elaborare la struttura di una proteina consiste nel dirigere un raggio di raggi X ad alta energia su un cristallo proteico e analizzare il modello di diffrazione che risulta dalle interazioni dei raggi X con gli elettroni degli atomi nel struttura. Sfortunatamente, I raggi X non interagiscono fortemente con atomi di idrogeno o protoni, che hanno una densità elettronica bassa o nulla, rendendoli difficili da "vedere".
Una soluzione è applicare un raggio di neutroni al cristallo invece dei raggi X. I neutroni interagiscono con i nuclei degli atomi nel loro percorso, compresi quelli di atomi di idrogeno e protoni, nonostante siano piccoli. I modelli di diffrazione risultanti da queste interazioni vengono registrati dopo che il fascio di neutroni è passato attraverso il cristallo, e sono decodificati nelle posizioni precise dei nuclei, compresi i nuclei di idrogeno.
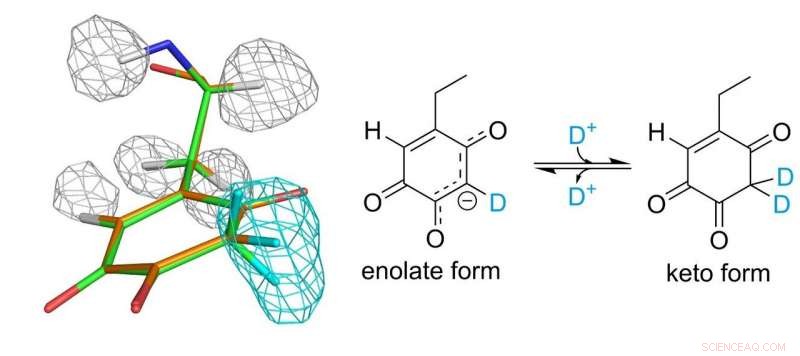
Struttura del cofattore topa chinone. Le maglie grigie e azzurre rappresentano le densità degli atomi di idrogeno e deuterio, rispettivamente. Credito:Università di Osaka
"Gli atomi e i protoni di idrogeno sono componenti particolarmente interessanti delle strutture enzimatiche perché possono esibire comportamenti quantistici che sono stati recentemente trovati cruciali per la funzione enzimatica. È quindi importante determinare con precisione la loro posizione nella struttura proteica per svelare ciò che sta accadendo , ", spiega l'autore corrispondente dello studio Toshihide Okajima. "Utilizzando la cristallografia a neutroni, siamo stati in grado di determinare la struttura di una rame ammino ossidasi batterica con un peso molecolare di 70, 600, che è estremamente grande per la cristallografia di neutroni e supera significativamente le masse molecolari precedentemente registrate, e ancora individua con precisione gli atomi di idrogeno e i protoni nella struttura. Un insolito protone "levitato" è stato osservato tra un cofattore, topa chinone, e un residuo amminoacidico rigorosamente conservato in questa classe di enzimi."
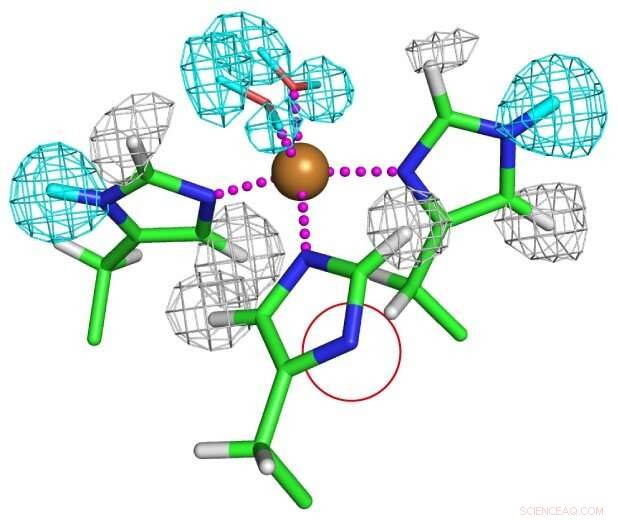
Stato di protonazione di residui di istidina coordinati al rame. Uno dei residui di istidina è completamente deprotonato come mostrato in un cerchio rosso per formare un insolito anione imidazolato. Credito:Università di Osaka
Il cofattore topa chinone legato covalentemente all'enzima svolge un ruolo essenziale nella funzione catalitica. I ricercatori sono stati finalmente in grado di stabilire un quadro completo del topa chinone 30 anni dopo la sua scoperta come cofattore derivato da proteine. Hanno scoperto che il cofattore esiste effettivamente in equilibrio tra due diverse forme.
"I siti attivi degli enzimi, dove avvengono le reazioni, possono fornirci una grande quantità di informazioni e ispirazione se siamo in grado di comprendere appieno cosa sta succedendo, " Spiega Okajima. "La nostra dimostrazione dell'uso della cristallografia di neutroni per scoprire gli effetti quantistici dei protoni promette di essere molto utile per molti ricercatori che studiano gli enzimi ei loro meccanismi".