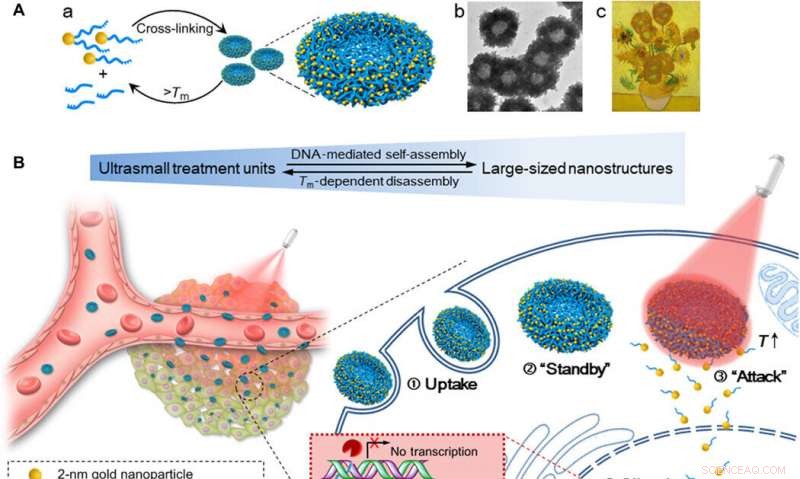
Schema di nanogirasole DNA-oro autoassemblati per una maggiore quantità di assorbimento cellulare, efficacia di silenziamento genico sintonizzabile, e l'effetto di inibizione del tumore controllato dall'irradiazione NIR. (A) (a) Assemblaggio e smontaggio della nanostruttura di grandi dimensioni (nanogirasoli d'oro-DNA da 200 nm) da/a nanoparticelle ultrapiccole (NP Au-POY2T da 2 nm). (b) Immagine TEM rappresentativa dei nanogirasoli. (c) Capolavoro:Girasoli (Vincent van Gogh, 1889). (B) A sinistra:ritenzione del tumore in vivo e penetrazione di nanogirasoli trasformabili. A destra:migliore assorbimento cellulare e processo di silenziamento dell'oncogene controllato dei nanogirasoli in vitro. ① Nanogirasoli di grandi dimensioni sono stati prelevati da una cellula MCF-7. ② I nanogirasoli stanno nel citoplasma cellulare. ③ In caso di irradiazione NIR, nanostrutture di DNA-oro di grandi dimensioni si dissociano e rilasciano piccole unità (2 nm Au-POY2T NP) per attaccare il nucleo cellulare. ④ La sequenza di silenziamento POY2T si legherà al promotore P2 dell'oncogene c-myc e diminuirà l'espressione di c-myc delle cellule MCF-7, che può essere controllato (ON/OFF) e regolato (Basso/Medio/Alto) dall'irraggiamento NIR. Credito: Progressi scientifici , doi:10.1126/sciadv.aaw6264
Lo sviluppo di un sistema di consegna efficiente per terapie basate sull'interferenza genica potenziate e controllate è una sfida esistente nella biologia molecolare. Il campo avanzato delle nanotecnologie può fornire un'efficace, strategia interdisciplinare per facilitare la consegna di acido nucleico. In un nuovo rapporto, Shuaidong Huo e colleghi dei dipartimenti interdisciplinari di Nanoscienze, Materiali interattivi, Chimica e ricerca sui polimeri in Cina, La Germania e gli Stati Uniti hanno utilizzato sequenze di oligonucleotidi che formano triplex accoppiate al suo filamento complementare per mediare l'autoassemblaggio di nanoparticelle d'oro ultra piccole.
Le nanostrutture a forma di girasole risultanti hanno mostrato un forte assorbimento del vicino infrarosso (NIR) e la capacità di conversione fototermica. Quando gli scienziati hanno irradiato le strutture con il NIR, le nanostrutture più grandi sono state smontate per generare nanoparticelle ultra-piccole modificate con la sequenza dell'oncogene c-Myc per colpire direttamente il nucleo della cellula cancerosa. Huo et al. silenziamento genico controllato controllando sinergicamente il tempo di preincubazione delle cellule con nanoparticelle insieme all'autoassemblaggio della nanostruttura (in vitro e in vivo) e l'intervallo di tempo dell'irradiazione NIR. Lo studio ha fornito un nuovo paradigma per costruire nanovettori efficienti e su misura per le applicazioni dell'interferenza genica e della somministrazione di geni terapeutici.
La terapia genica ha un grande potenziale per trattare una varietà di malattie e complicazioni tra cui l'infertilità, HIV e cancro. Il successo della terapia genica per alleviare i sintomi della malattia dipende da un efficiente veicolo o vettore di consegna genica. Durante il processo, il vettore del gene deve attraversare molte barriere biologiche e membrane cellulari mentre sfugge all'intrappolamento endosomiale e alla degradazione basata sulla nucleasi. Rispetto alle strategie di consegna basate su virus, gli approcci di consegna genica non virale affrontano molte sfide durante il processo di caricamento e rilascio di DNA/RNA, consegna mirata e assorbimento intracellulare, compresa l'incompatibilità relativa alle risposte immunitarie in vivo.
Sono in corso sforzi vigorosi nella nanotecnologia per progettare veicoli stabili ed efficienti per il trasferimento genico alle cellule tumorali. Grazie alle loro proprietà fisico-chimiche uniche, sono emersi numerosi nanomateriali per la consegna genica. Tra loro, nanoparticelle d'oro (Au NP) con dimensioni e proprietà superficiali specifiche possono superare gli ostacoli in vivo per diventare uno dei sistemi di trasporto genico più studiati. Però, queste strategie hanno incontrato una serie di carenze e quindi è importante stabilire sistemi di consegna efficienti o terapie geniche potenziate e controllate.
Autoassemblaggio e test di nanostrutture simili a girasole
Nel presente lavoro, Huo et al. sono stati ispirati dalla capacità della natura di ibridare il DNA mediante l'ingegneria mediata dal DNA, nanostrutture di DNA d'oro autoassemblate (circa 200 nm). Il design simile al girasole ha mostrato un forte assorbimento NIR e proprietà di conversione fototermica. Dopo l'irradiazione NIR, le strutture smontate per liberare nanoparticelle d'oro ultra-piccole (2 nm, Au NP) con potenziale di silenziamento dell'oncogene, miglioramento della permeabilità cellulare e dei nuclei e maggiore efficienza di trasfezione. Gli scienziati hanno controllato sinergicamente le interazioni cellula-nanomateriale in base al tempo di pre-incubazione in laboratorio, seguito dal tempo di circolazione in vivo e dalla linea temporale dell'irradiazione. Gli esperimenti hanno facilitato un aumento dell'assorbimento cellulare, efficacia di silenziamento genico sintonizzabile e inibizione controllata del tumore. I nanogirasoli trasformabili hanno fornito un modello eccellente per progettare nanoveicoli per la somministrazione di farmaci con un grande potenziale in biomedicina.
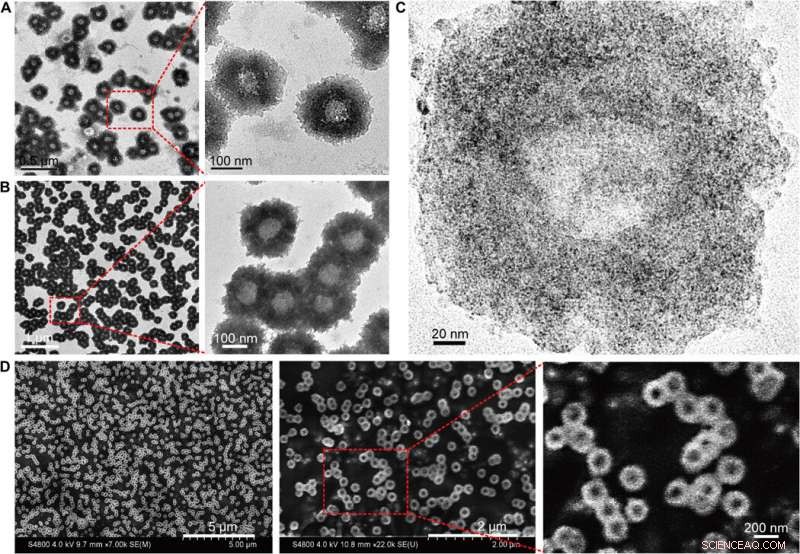
Caratterizzazione morfologica delle nanostrutture autoassemblate (nanogirasole). (A) Immagini TEM (200 kV) dei nanogirasoli con dettagli strutturali ingranditi. (B) Immagini Bio-TEM (80 kV) con dettagli strutturali polimerici ingranditi. (C) Immagini TEM ad alta risoluzione (200 kV) che mostrano la distribuzione di NP ultrapiccole sulla nanostruttura autoassemblata. (D) Immagini SEM con topografia superficiale ingrandita dei nanogirasoli. Credito:progressi scientifici, doi:10.1126/sciadv.aaw6264
Huo et al. ha prima sintetizzato le NP Au a due nanometri rivestite con tiopronina e le ha modificate con tiolo-oligonucleotidi (SH-POY2T) utilizzando un metodo consolidato di scambio di ligandi. L'oligonucleotide 23-nucleotide (nt) POY2T ha legato il promotore P2 dell'oncogene c-myc per formare una struttura triplex e sottoregolare l'espressione oncogenica di c-myc. In parallelo, hanno progettato e sintetizzato un'altra sequenza a singolo filamento nota come CA per ibridarsi in modo complementare alla coda della sequenza POY2T e bloccarne il legame con l'oncogene c-myc. Al termine, la nanostruttura autoassemblata in strutture simili a girasoli. Il team ha studiato la nanostruttura (200 nm) utilizzando la microscopia elettronica a trasmissione (TEM). Ulteriori immagini hanno rivelato ulteriori dettagli delle frazioni di DNA della struttura "girasole". Quando gli scienziati dei materiali hanno utilizzato la microscopia elettronica a scansione (SEM) per convalidare i risultati TEM, hanno osservato la coerenza tra i metodi.
Hanno studiato gli spettri di assorbimento UV-Vis delle NP Au ultrapiccole prima dell'autoassemblaggio mediato dal DNA. Il monodisperso, le singole NP Au-POY2T a due nanometri hanno mostrato un forte assorbimento nella regione NIR per generare calore sotto irraggiamento NIR. Huo et al. ha accreditato la forte assorbanza NIR osservata per chiudere la spaziatura tra le particelle e la distribuzione spaziale non uniforme delle singole NP all'interno della nanostruttura più grande. Hanno testato la risposta al calore delle nanostrutture autoassemblate sotto irraggiamento NIR e hanno notato che il punto di fusione delle sequenze di DNA complementari (POY2T e CA) si avvicinava a 41 gradi C, dissociando metà della struttura duplex tra sequenze di DNA complementari. Huo et al. selezionato 10 minuti come tempo ottimale per l'irradiazione NIR nello studio.
Studio delle proprietà fototermiche e del comportamento di disassemblaggio delle nanostrutture autoassemblate. (A) Spettri di assorbimento visibili di NP di dimensioni pari a 2 nm e nanostrutture autoassemblate da 200 nm. a.u., unità di assorbanza. (B) Risposta in temperatura di nanostrutture autoassemblate, su irradiazione NIR, disperso in acqua e terreno di coltura cellulare. Valori medi ± SD, n =3. (C) Aumento della temperatura delle nanostrutture autoassemblate, su irradiazione NIR, dispersi in acqua e terreno di coltura cellulare. (D) Modifica dell'assorbanza massima (767 nm) di NP con dimensioni del nucleo di 2 nm e nanostrutture autoassemblate da 200 nm su irradiazione NIR. (E e F) Osservazione TEM del comportamento di smontaggio di nanostrutture autoassemblate da 200 nm prima (in alto) e dopo (in basso) irradiazione NIR (808 nm, 10 minuti). (G) Diametro idrodinamico di (a) NP Au-POY2T monodisperse da 2 nm e variazione di dimensione dei nanogirasoli da 200 nm prima (b) e dopo (c e d) irradiazione NIR per diversi periodi di tempo (3 e 10 min). Credito:progressi scientifici, doi:10.1126/sciadv.aaw6264 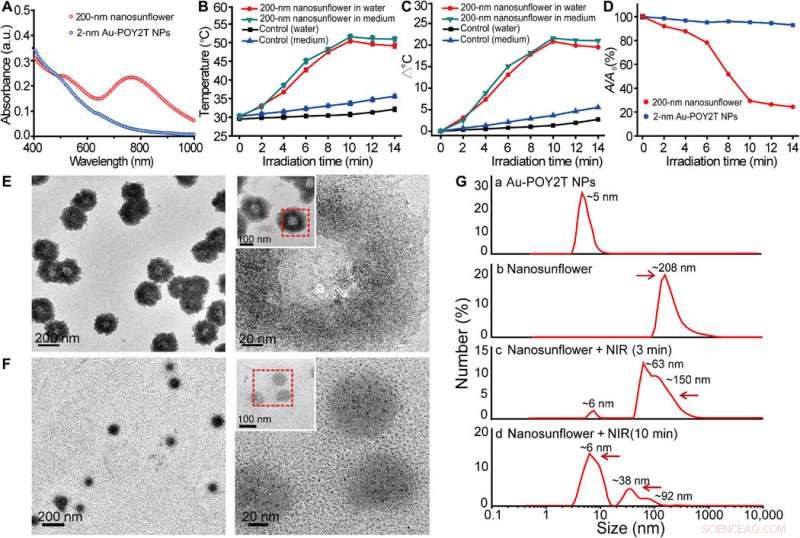
Gli scienziati hanno ipotizzato che le nanostrutture autoassemblate si sarebbero ridotte e disassemblate in singole NP Au-POY2T ultrapiccole. Dopo 10 minuti di irradiazione NIR, l'assorbimento massimo (767 nm) delle nanostrutture è notevolmente diminuito per smontare la struttura del girasole. Hanno seguito gli esperimenti prima e dopo l'irradiazione NIR con osservazioni TEM e hanno utilizzato analizzatori di dimensioni delle particelle per comprendere il processo di smontaggio e la trasformazione dimensionale delle nanostrutture di dimensioni fino a sei nanometri e hanno confermato l'idoneità ottimale della sequenza temporale di 10 minuti.
Huo et al. ha applicato l'irradiazione NIR a cellule MCF-7 trattate con nanostrutture di DNA d'oro autoassemblate e ne ha testato l'assorbimento cellulare in vitro come prova di concetto. Hanno determinato l'internalizzazione cellulare di Au-POY2T (2 nm) in diversi tempi di incubazione e quantificato il loro assorbimento cellulare utilizzando la spettroscopia di massa del plasma accoppiato induttivamente (ICP-MS) e metodi precedenti. Hanno notato un aumento dell'internalizzazione dopo sei ore di incubazione rispetto alle tempistiche di incubazione di 24 ore. Non hanno osservato inibitori dell'endocitosi per influenzare l'assorbimento di Au-POY2T NP, suggerendo il coinvolgimento di un percorso alternativo come la fusione della membrana.
Comprensione del comportamento di silenziamento genico delle nanostrutture autoassemblate
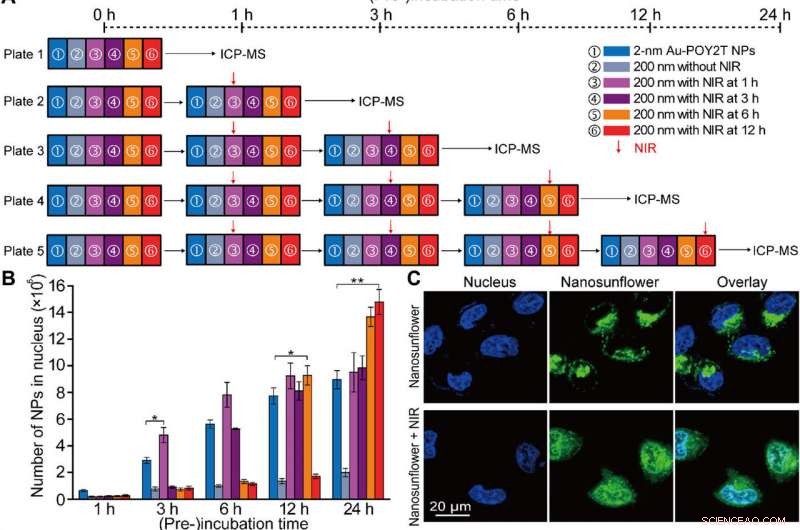
Localizzazione controllata del nucleo e studio di silenziamento genico in vitro delle nanostrutture autoassemblate. (A) Schema del setup sperimentale cellulare in vitro per la localizzazione controllata del nucleo NP e lo studio di regolazione genica. (B) Numero di NP Au-POY2T da 2 nm localizzati nel nucleo della cellula MCF-7 con trattamento di ① NP Au-POY2T da 2 nm individuali, ② nanogirasole da 200 nm, e nanogirasole da 200 nm con irradiazione NIR (10 min) dopo diversi tempi di preincubazione (③ 1, 3, 6, e 12 ore). Valori medi ± SD, n =3. Le differenze statistiche sono state determinate dal test t di Student a due code; *P<0,05 e **P<0,01. (C) Osservazione confocale della distribuzione di nanogirasoli marcati con isotiocianato di fluoresceina (verde) prima (in alto) e dopo (in basso) l'irradiazione NIR nelle cellule MCF-7. Il nucleo è stato etichettato da 4′, 6-diamidino-2-fenilindolo (blu). (D) Immagine Bio-TEM della localizzazione di nanogirasoli di grandi dimensioni (in alto, freccia rossa) nel citoplasma e distribuzione delle piccole NP rilasciate (in basso, freccia blu) nel citoplasma e nel nucleo dopo irradiazione NIR in cellule MCF-7. (E) Valutazione della citotossicità delle cellule MCF-7 con trattamento di nanogirasole da 200 nm dopo irradiazione NIR (dopo un periodo di tempo di preincubazione:1, 3, 6, e 12 ore, rispettivamente) rispetto al controllo, NP Au-TIOP a 2 nm, sequenza POY2T, sequenza CA, NP Au-POY2T da 2 nm, nanogirasole da 200 nm senza irradiazione NIR, e solo esposizione al NIR. Tutte le concentrazioni dei trattamenti erano pari o uguali a 1 μM nella sequenza POY2T e sono state testate dopo un totale di 24 ore di incubazione. Valori medi ± SD, n =3. Le differenze statistiche sono state confrontate con il gruppo di trattamento di ① NP Au-POY2T individuali da 2 nm determinate dal test t di Student a due code; *P<0,05 e **P<0,01. (F) Livello di mRNA di C-myc determinato mediante PCR in tempo reale dopo diversi trattamenti come descritto sopra. Valori medi ± SD, n =3. Le differenze statistiche sono state determinate dal test t di Student a due code; **P<0,01 e ***P<0,001. (G) Livelli della proteina C-myc determinati mediante Western blot e (H) corrispondente istogramma quantitativo dopo diversi trattamenti come descritto sopra. GAPDH, gliceraldeide fosfato deidrogenasi. Credito:progressi scientifici, doi:10.1126/sciadv.aaw6264
Dopo un maggiore assorbimento cellulare di nanostrutture autoassemblate in vitro, il team di ricerca ha studiato la distribuzione delle nanoparticelle all'interno dei nuclei cellulari utilizzando strategie di "attesa" e di "attacco" dopo l'attivazione del NIR. Per questo, hanno estratto i nuclei delle cellule dopo l'incubazione, per l'analisi ICP-MS dopo irradiazione NIR in diversi periodi di incubazione (uno, tre, sei e dodici ore). Hanno notato che il periodo di pre-incubazione influenza in gran parte l'internalizzazione delle nanoparticelle all'interno del nucleo cellulare, ei ricercatori hanno regolato le NP Au-POY2T nel nucleo cellulare in base al tempo di pre-incubazione e all'irradiazione NIR.
Huo et al. ha anche studiato gli effetti terapeutici controllati dall'irradiazione NIR dei nanogirasoli utilizzando test di vitalità cellulare; hanno osservato che il silenziamento dell'oncogene aumenta notevolmente (80%) e uccide più cellule tumorali. Il team di ricerca ha controllato efficacemente l'impatto terapeutico modificando in modo efficiente la sequenza temporale della pre-incubazione e dell'irradiazione. I risultati hanno supportato una capacità superiore dei nanogirasoli trasformabili di silenziare l'oncogene e l'oncoproteina c-myc. Gli scienziati hanno controllato il processo di silenziamento genico regolando le tempistiche di pre-incubazione prima dell'irradiazione NIR.
Controllo dell'inibizione della crescita tumorale utilizzando nanogirasoli autoassemblati
Per testare l'efficienza antitumorale controllabile dei nanogirasoli in vivo, gli scienziati hanno prima studiato la loro compatibilità con il sangue per confermare una buona biocompatibilità del sangue. Il team di ricerca ha quindi stabilito il modello di tumore MCF-7 utilizzando i topi nudi BALB/c, ha permesso ai volumi del tumore di raggiungere i 50 mm 3 e ha diviso casualmente gli animali in nove gruppi e li ha trattati con 1000 µl di diverse formulazioni di POY2T. Dopo ogni iniezione, hanno irradiato i gruppi animali con laser NIR per 10 minuti per raggiungere una temperatura locale superiore a 41 gradi C.
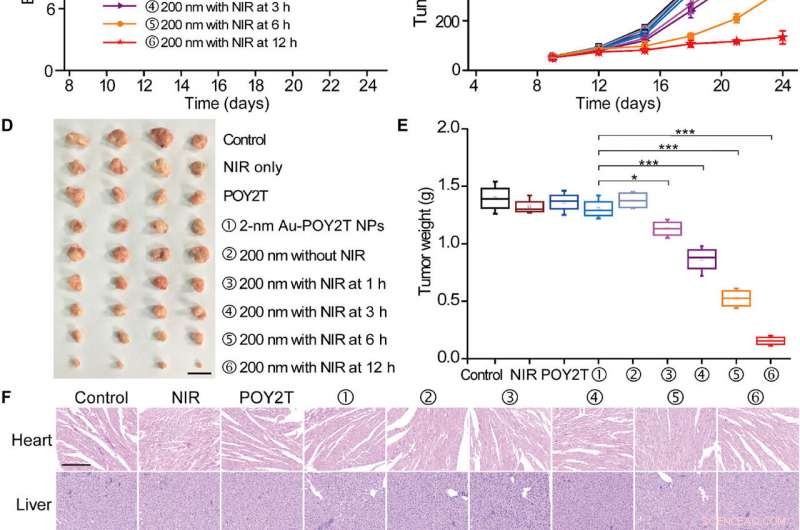
Studio di inibizione della crescita tumorale controllata delle nanostrutture autoassemblate. (A) Il modello di topi nudi del tumore MCF-7 BALB/c è stato stabilito al giorno 0. Dopo che i tumori erano pronti, i topi sono stati divisi casualmente in nove gruppi e trattati con 100 μl di varie formulazioni (equivalenti a 10 μM nella sequenza POY2T; gruppo con NP Au-POY2T a 2 nm e gruppi ②, , , , e ⑥ con nanogirasole da 200 nm) ai giorni 9, 12, e 15. Nei gruppi ③, , , e , i tumori sono stati irradiati con un laser NIR per 10 min a 1, 3, 6, e 12 ore dopo ogni iniezione endovenosa. salina, solo NIR, e POY2T sono stati usati come gruppi di controllo. Il peso corporeo (B) e il volume tumorale (C) sono stati misurati ogni 3 giorni. Barra della scala, 1 cm. Dopo che i topi sono stati sacrificati al giorno 24, tutti i tumori sono stati (D) isolati e (E) pesati, rispettivamente. Valori medi ± SD, n =4. Le differenze statistiche sono state determinate dal test t di Student a due code; *P <0,05, **P <0,01 e ***P <0,001. (Credito fotografico:Ningqiang Gong, Centro nazionale per le nanoscienze e la tecnologia, Cina.) (F) Immagini di colorazione con ematossilina ed eosina di organi compreso il cuore, fegato, milza, polmone, rene, e tumore dopo diversi trattamenti. Barra della scala, 200 micron. Credito:progressi scientifici, doi:10.1126/sciadv.aaw6264
Di nota, i topi trattati con il gruppo trattato con nanogirasole e irradiati a 12 ore hanno mostrato gli effetti antitumorali più significativi, indicando la consegna efficiente di unità di silenziamento genico nel sito del tumore. Dopo 24 giorni, Huo et al. sacrificato gli animali, hanno isolato i tumori e li hanno pesati per dimostrare l'inibizione della crescita tumorale controllata da NIR basata su nanogirasole in vivo. Sulla base di studi istologici, il team ha mostrato che il trattamento ha ridotto significativamente la crescita del tumore e non ha influenzato la morfologia di altri organi. I risultati hanno verificato l'efficienza terapeutica e l'assenza di effetti collaterali per i nanogirasoli e la terapia NIR.
In questo modo, Shuaidong Huo e colleghi hanno progettato, nanoagenti sviluppati e ottimizzati per un'efficace terapia antitumorale. Hanno progettato nanostrutture simili a girasole autoassemblate per agire come vettori multiparticelle caricati con molte unità terapeutiche ultrapiccole. All'irradiazione NIR, le nanostrutture si sono dissociate per rilasciare sciami di piccole NP per colpire il nucleo cellulare. Nei topi portatori di tumore, i grandi girasoli miravano passivamente al sito del tumore, seguiti dall'irradiazione NIR per trasformare la composizione genetica del tumore e ridurla. Il team di ricerca mira a migliorare l'efficienza della trasfezione e fornire un modello per il silenziamento genico controllabile nei siti tumorali utilizzando portatori di interferenza genica trasformabili per intricate teranostica a livello della singola cellula.
© 2019 Scienza X Rete