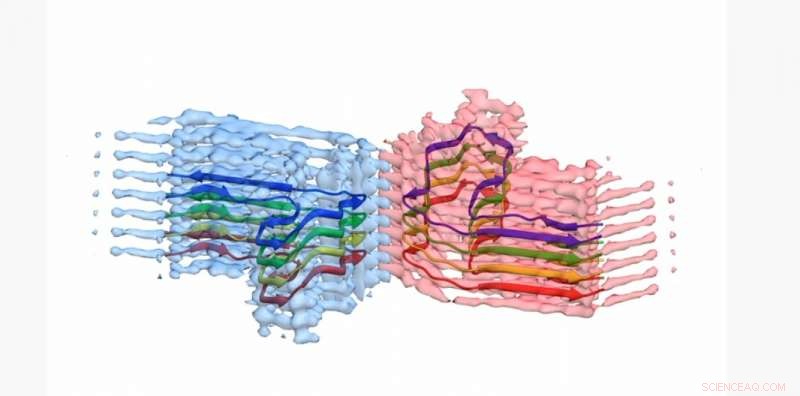
Una sezione di una fibrilla amiloide b2m, con il modello atomico per 8 copie della proteina b2m incorporata nella densità EM. La fibrilla è costituita da due "protofilamenti" che si avvolgono l'uno attorno all'altro (blu e rosa). Questa sezione è lunga circa 4 miliardesimi di metro Credito:Università di Leeds
La secolare missione per capire come le proteine responsabili di malattie a base di amiloide come l'Alzheimer, Il lavoro di Huntingdon e Parkinson ha fatto grandi passi avanti negli ultimi 12 mesi, grazie a una rivoluzione in una potente tecnica di microscopia utilizzata dagli scienziati.
Microscopi ad alta potenza che utilizzano elettroni invece della luce per "vedere" la forma effettiva dei campioni posti sotto di loro, a livelli di dettaglio quasi atomici, sono diventati disponibili solo di recente per gli scienziati britannici.
Il Regno Unito ha investito molto nei microscopi crioelettronici "rivoluzionari", ma ci sono ancora meno di 25 degli strumenti multimilionari nelle università e negli istituti di ricerca del Regno Unito.
I due strumenti dell'Università di Leeds, finanziato dalla stessa Università e da Wellcome, sono gli unici del loro genere nel nord dell'Inghilterra.
Hanno già dimostrato il loro valore come strumento chiave per gli scienziati che li hanno utilizzati in numerosi progetti di ricerca, ma hanno appena ottenuto il loro più grande successo:rivelare la struttura dell'amiloide, un accumulo di proteine anormali nel corpo che causa la malattia.
Ci sono meno di 10 immagini e strutture di buona qualità di questo tipo di proteine disponibili per lo studio nel mondo, quindi la ricerca di Leeds fornisce un contributo significativo alla comprensione da parte degli scienziati di come le proteine formano aggregati e di come potrebbero contribuire alla malattia dell'amiloide.
Le immagini e le strutture 3D degli aggregati proteici, che gli scienziati di Leeds hanno mostrato, si sono formate a lungo, fibre intrecciate—è stato pubblicato sulla rivista Comunicazioni sulla natura . La proteina coinvolta, la β2-microglobulina, è normalmente coinvolta in un sistema immunitario sano, ma può assemblarsi nelle fibre amiloidi che causano dolore nelle persone che si sottopongono a dialisi a lungo termine per insufficienza renale. Quando si depositano nelle articolazioni delle persone possono causare l'artrosi
Si prevede che i risultati saranno utilizzati dai produttori di farmaci e dai gruppi di ricerca internazionali che si sforzano di finanziare cure per le malattie amiloidi di tutti i tipi.
Professoressa Sheena Radford FMedSci, FRS e il professor Neil Ranson dell'Astbury Center for Structural Molecular Biology dell'università, ha guidato il programma quinquennale per visualizzare le fibre proteiche e mostrare la loro struttura 3-D.
La coppia è stata supportata dai colleghi di Leeds, Josh Boardman, che all'epoca era uno studente universitario in Biochimica.

La dottoressa Rebecca Thompson, il Cryo-Electron Microscopy Center Manager dell'Università di Leeds carica un campione in uno dei microscopi. Credito:Università di Leeds
Lo studio ha comportato anche una collaborazione di lunga data con il professor Bob Griffin, del Massachusetts Institute for Technology, specializzato in un altro metodo di analisi biologica avanzata della materia biologica:la risonanza magnetica nucleare allo stato solido.
Il professor Radford ha dichiarato:"Negli ultimi sei decenni da quando sono state create le prime immagini al microscopio elettronico dell'amiloide, gli scienziati sono passati dal lavorare con immagini sfocate a bassa risoluzione alle nostre immagini e strutture 3D nitidissime, grazie ai moderni progressi della microscopia crioelettronica.
"Ora sappiamo esattamente dove si trova ogni nodo e punto sulla proteina, potremmo essere in grado di sviluppare composti che si legano strettamente ad esso, o interromperlo, e scopri come le fibre contribuiscono alla malattia. È l'equivalente di passare dal tentativo di far aderire due palloncini all'avere due ingranaggi che ruotano perfettamente l'uno con l'altro.
Ha aggiunto:"Abbiamo usato la microscopia crioelettronica non solo per scoprire la forma e la struttura delle proteine amiloidi, ma anche come crescono e si intrecciano tra loro come i supporti in una corda per formare assemblaggi più grandi. Questa conoscenza sarà cruciale per sapere come affrontarli".
Il professor Ranson ha dichiarato:"Fino a un anno fa, gli scienziati sapevano che la struttura assomigliava più o meno a una scala, ma ora abbiamo dimostrato che è molto più complesso di così. Ora stiamo iniziando a vedere come diverse proteine si ripiegano in forme diverse e come queste variano con ogni malattia che causano.
"I dettagli extra che abbiamo scoperto significano che possiamo iniziare a capire le capacità di causare malattie di queste proteine.
Ha aggiunto:"Le fibre amiloidi sono anche note per avere la forza dell'acciaio, e, ora comprendiamo le loro strutture. Potremmo essere in grado di creare nuovi biomateriali ispirati alle loro strutture. Questo è un ottimo esempio di dove la microscopia crioelettronica può avere ulteriori vantaggi".
Conoscendo la struttura della proteina nel livello di dettaglio fornito dai ricercatori di Leeds, e misurare queste differenze nei diversi tipi di malattia amiloide e nei diversi pazienti, potrebbe anche consentire ai medici di mostrare chi sarebbe più a rischio, il che significa che il trattamento può essere mirato a coloro che ne hanno più bisogno.
Il prossimo passo per la comunità scientifica è iniziare a identificare e sviluppare inibitori, composti che possono controllare l'assemblaggio delle proteine nell'amiloide. Il professor Radford ha ottenuto quasi 2 milioni di sterline da Wellcome per portare a termine questa fase di sviluppo.
Ulteriori prove di laboratorio, test clinici, l'approvazione normativa e il coinvolgimento di uno sviluppatore di farmaci sarebbero ancora necessari prima che i farmaci possano essere immessi sul mercato, ma i significativi passi avanti nella chiarezza dell'immagine e nella comprensione della struttura del ripiegamento dell'amiloide segnano un importante balzo in avanti.
Il documento di ricerca completo La struttura di una fibrilla β2microglobulina suggerisce una base molecolare per il suo polimorfismo amiloide è pubblicata in Comunicazioni sulla natura .