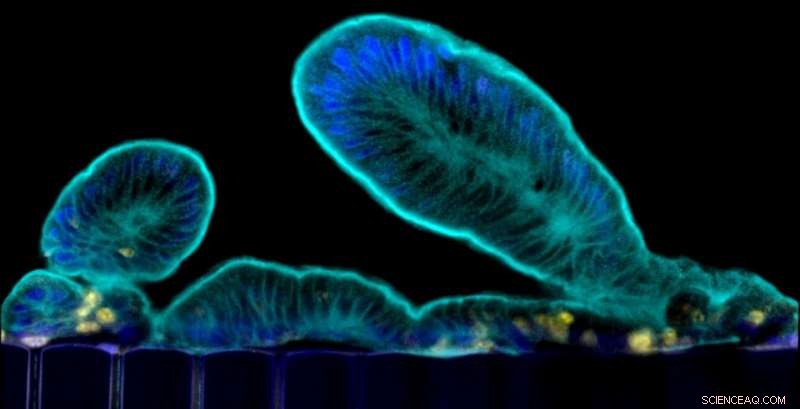
Estensioni simili a villi che le cellule primarie del piccolo intestino sporgono nel lume del canale epiteliale del chip. Credito:Wyss Institute presso l'Università di Harvard
L'intestino tenue è il sito principale in cui digeriamo e assorbiamo nutrienti e minerali dal cibo, ed è anche un luogo dove si verificano molte infezioni intestinali e si manifestano disturbi digestivi e infiammatori. Per comprendere meglio l'intestino nei suoi stati normali e patologici, i ricercatori hanno creato "organoidi" isolando cellule staminali intestinali da campioni di biopsie umane. Questi organoidi formano tutti i tipi di cellule presenti nell'intestino umano, ma crescono come cisti circondate da spessi gel di matrice extracellulare con la loro superficie cellulare "apicale" (che è normalmente esposta al contenuto dell'intestino) rivolta verso un lume chiuso. Ciò impedisce lo studio dei processi dinamici che coinvolgono la barriera intestinale, compreso il trasporto di nutrienti e farmaci, così come le sue interazioni con il microbioma. Inoltre, gli organoidi mancano di un sistema vascolare e dei movimenti meccanici causati dalla normale peristalsi e flusso sanguigno, che sono vitali per molti processi nell'intestino, compresa la sua rigenerazione e controllo della crescita eccessiva batterica.
Nel tentativo di superare questi limiti, un team del Wyss Institute for Biologically Inspired Engineering guidato dal suo direttore fondatore, Donald Ingber, M.D., dottorato di ricerca, aveva precedentemente progettato un dispositivo di coltura microfluidico "Organ-on-a-Chip" (Organ Chip) in cui le cellule di una linea cellulare intestinale umana originariamente isolate da un tumore venivano coltivate in uno dei due canali paralleli, separato da una membrana porosa rivestita di matrice dalle cellule endoteliali derivate dai vasi sanguigni umani nel canale adiacente. Sebbene questo chip intestinale umano abbia ricreato l'epitelio dei villi dell'intestino normale e abbia permesso nuove intuizioni su come il flusso e la peristalsi ciclica influenzino la differenziazione e la funzione intestinale, non poteva essere utilizzato per studiare processi che si basavano su cellule intestinali normali di singoli donatori, quale, Per esempio, è fondamentale per studiare le risposte specifiche del paziente per la medicina personalizzata.
In un nuovo studio, pubblicato in Rapporti scientifici , Il team di Ingber ora rimuove questi blocchi stradali. "Ora siamo in grado di sfruttare l'approccio organoide per isolare le cellule staminali intestinali da biopsie umane, ma spezziamo gli organoidi e coltiviamo le cellule specifiche del paziente all'interno dei nostri Organ Chips dove formano spontaneamente i villi intestinali orientati verso il lume del canale, e l'epitelio in stretta apposizione all'endotelio microvascolare intestinale umano, "disse Ingber, che è anche Judah Folkman Professor of Vascular Biology presso la Harvard Medical School (HMS) e il Vascular Biology Program presso il Boston Children's Hospital, nonché Professore di Bioingegneria presso la John A. Paulson School of Engineering and Applied Sciences (SEAS) di Harvard. "Questo approccio rappresenta un nuovo trampolino di lancio per lo studio dei processi normali e correlati alla malattia in modo altamente personalizzato, compreso il trasporto di nutrienti, digestione, diversi disturbi intestinali, e le interazioni intestinali con i microbi commensali e gli agenti patogeni".
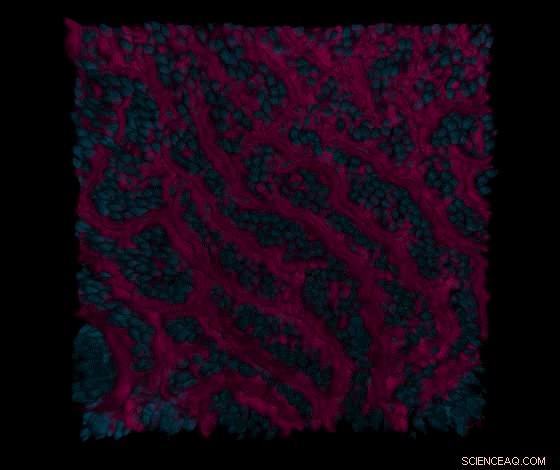
Una serie di sezioni di microscopia confocale prese attraverso i canali intestinali epiteliali e vascolari dell'intestino tenue primario visualizza prima la superficie delle strutture epiteliali simili ai villi (in rosso) e i nuclei (in blu) delle cellule epiteliali dell'intestino tenue nel canale intestinale, e quindi i contatti cellula-cellula (in verde) delle cellule endoteliali intestinali nel canale vascolare adiacente. Credito:Wyss Institute presso l'Università di Harvard
Il team ha collaborato con il laboratorio di David Breault presso il Boston Children's Hospital per creare una fase di coltura di organoidi nella procedura per isolare le cellule staminali intestinali normali e aumentare il numero di cellule. Gli organoidi risultanti potrebbero essere depositati per un uso futuro o immediatamente frammentati e seminati nei canali "epiteliali" di più Organ Chips dove sono stati ulteriormente maturati facendo scorrere un mezzo di coltura specializzato e applicando una stimolazione meccanica ai canali per imitare i movimenti fisiologici simili alla peristalsi. La maturazione dell'epitelio in un epitelio intestinale dei villi con lunghe estensioni simili a dita è stata aiutata dalla co-coltura di cellule endoteliali microvascolari intestinali umane sul lato opposto della membrana porosa ricoperta di matrice condivisa nel canale "vascolare" dove hanno assemblato un sangue surrogato vaso con un lume cavo attraverso il quale scorreva il mezzo di alimentazione.
Così, combinando due delle tecnologie più avanzate nel campo dell'ingegneria dei tessuti ? coltura di organoidi e frammenti di organi ? ha permesso la generazione di tessuti intestinali e strutture a livello di organi rivestiti da cellule umane specifiche del donatore con morfologia, composizione, e funzione molto simile a quella della regione duodenale del normale intestino tenue. "Poiché il chip primario dell'intestino tenue ricapitola il microambiente fisico che le cellule sperimentano all'interno del corpo umano, come il flusso di fluido e movimenti di allungamento simili alla peristalsi ciclica, presenta un profilo di espressione genica dell'intero genoma che si avvicina di più alla sua controparte in vivo rispetto a quello delle stesse cellule intestinali cresciute come organoidi 3D, " ha detto la prima autrice Magdalena Kasendra, dottorato di ricerca, un ex borsista post-dottorato nel team di Ingber e ora scienziato principale presso Emulate, Inc. a Boston.
Insieme alle cellule staminali intestinali, il team ha identificato enterociti differenziati che digeriscono e assorbono i nutrienti, cellule caliciformi che producono muco, cellule enteroendocrine che secernono ormoni, e cellule di Paneth che regolano e rilevano il microbioma, e hanno eseguito una serie di saggi che hanno confermato le loro funzioni. Poiché il microambiente dell'intestino tenue può essere mantenuto per settimane in Organ Chips continuamente perfusi, consentono studi sia a breve che a lungo termine le cui osservazioni possono essere ricondotte alla salute e alla fisiologia dei singoli donatori.
Il team di Ingber sta ora applicando lo stesso approccio a diverse regioni dell'intestino:duodeno, digiuno, ileo, e colon, le cui funzioni e vulnerabilità alla malattia differiscono l'una dall'altra. Questo approccio viene anche utilizzato per decodificare ambienti intestinali ancora più complessi integrando altri tipi di cellule, come le cellule immunitarie, cellule neuronali, e microbi commensali nel dispositivo. "Nel futuro, tali sforzi potrebbero consentirci di comprendere molto meglio le interazioni uomo-microbioma, modelli di disturbi da malnutrizione e malattie infiammatorie dell'intestino, ed eseguire test antidroga personalizzati, " ha detto il co-primo autore Alessio Tovaglieri, uno studente laureato presso il Dipartimento di scienze e tecnologie della salute presso l'ETH di Zurigo in Svizzera, che svolge il suo lavoro di tesi nel team di Ingber.