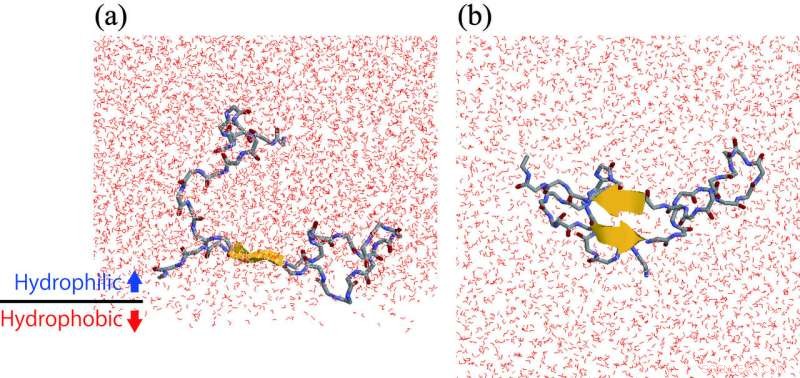
(a) Un peptide Aβ che forma una struttura a forcina β all'interfaccia idrofila/idrofobica. (b) Vista dalla parte inferiore del pannello (a). Credito:ExCELLS/IMS
La malattia di Alzheimer è causata da aggregati di peptidi amiloide-β (Aβ). Questa aggregazione è accelerata sulla superficie della membrana cellulare. Utilizzando simulazioni di dinamica molecolare ed esperimenti NMR, il gruppo di ricerca di ExCELLS ha svelato il motivo di questo fenomeno. I risultati sono stati pubblicati nel Journal of Physical Chemistry B .
Molte proteine si aggregano a concentrazioni più elevate e formano sostanze sferiche chiamate oligomeri e sostanze aciculari chiamate fibrille amiloidi. Questi aggregati proteici causano più di 30 tipi di malattie. Per esempio, Si pensa che la malattia di Alzheimer sia causata dagli oligomeri e dalle fibrille amiloidi formate dall'aggregazione dei peptidi amiloide-β (Aβ). È noto che l'aggregazione del peptide Aβ è accelerata in corrispondenza di un'interfaccia idrofila/idrofobica come una superficie di membrana cellulare. Però, il motivo per cui i peptidi Aβ tendono ad aggregarsi sulla superficie non è stato ancora ben compreso.
Il gruppo di ricerca dell'Exploratory Research Center on Life and Living Systems e Institute for Molecular Science, Giappone, ha lavorato su questo problema utilizzando simulazioni di dinamica molecolare ed esperimenti di spettroscopia di risonanza magnetica nucleare. Hanno scoperto che i peptidi Aβ tendono a riunirsi all'interfaccia idrofila/idrofobica. Questo è, la concentrazione locale di Aβ all'interfaccia è maggiore di quella nella soluzione acquosa sfusa. Inoltre, Le strutture -tornanti si formano più all'interfaccia che nella soluzione acquosa sfusa. Nella struttura -tornante, come mostrato in figura, una parte del peptide Aβ si estende rettilinea e forma legami idrogeno intramolecolari. Perciò, un altro peptide Aβ che si avvicina a questo peptide forma facilmente legami idrogeno intermolecolari e tende ad aggregarsi. In questo modo, il gruppo di ricerca ha chiarito che l'accelerazione dell'aggregazione dei peptidi Aβ sulla superficie della membrana cellulare è dovuta all'elevata concentrazione di peptidi Aβ sulla superficie della membrana cellulare, e la loro struttura, per cui si legano tra loro.
Questa scoperta chiarisce il meccanismo con cui il peptide Aβ si aggrega sulla superficie della membrana delle cellule nervose. Questo meccanismo potrebbe essere applicato in futuro allo sviluppo di inibitori contro le sostanze responsabili del morbo di Alzheimer.