Trasformazione atomico-economica di eteri benzilici in acetali mediante catalisi del titanocene (III) in fasi a singolo elettrone (SET). Angewandte Chemie, DOI:10.1002/anie.202013561
Gli acetali sono importanti composti chimici che vengono utilizzati, Per esempio, nella produzione di alcuni agenti medici. Un nuovo metodo ora rende la loro sintesi più facile e più rispettosa dell'ambiente. I chimici dell'Università di Bonn hanno sviluppato e ottimizzato il processo catalitico sostenibile. Sono state utilizzate anche simulazioni al computer all'avanguardia. La reazione si basa su un meccanismo che si verifica frequentemente in natura, ma è stato usato raramente nella sintesi chimica fino ad ora. I risultati sono pubblicati sulla rivista Angewandte Chemie .
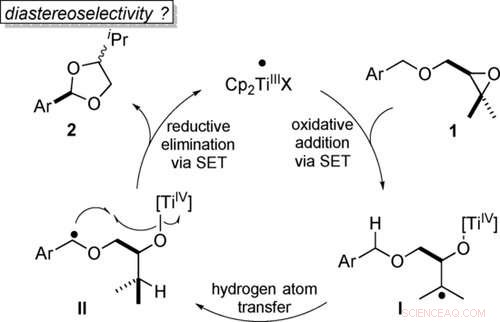
Il passaggio chiave nella produzione di acetali è il legame di due atomi di ossigeno a un atomo di carbonio. I chimici ottengono spesso questa disposizione con l'ossidazione. Per ottenere ciò vengono normalmente utilizzati agenti ossidanti forti rilasciando un atomo di ossigeno durante la reazione. Il resto dell'agente ossidante deve essere smaltito dopo la sintesi.
"Nel nostro studio, però, descriviamo un percorso che viene definito atomico-economico, nel senso che non genera rifiuti, " spiega il prof. Dr. Andreas Gansäuer dell'Istituto di chimica organica e biochimica di Kekulé dell'Università di Bonn. "La stessa molecola di partenza contiene già l'atomo di ossigeno necessario per l'ossidazione. La catalisi che abbiamo sviluppato sposta semplicemente questo ossigeno nella molecola, che crea l'acetale."
La molecola di partenza contiene un cosiddetto gruppo epossidico, una sorta di "triangolo" in cui due angoli sono formati da atomi di carbonio e il terzo da un atomo di ossigeno. Tali anelli tripli sono sottoposti a una grande tensione e quindi si rompono facilmente all'atomo di ossigeno. Gli epossidici immagazzinano l'energia di reazione necessaria come una molla compressa.
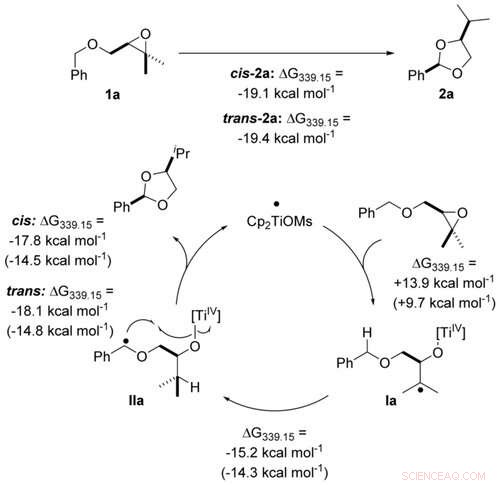
Trasformazione atomico-economica di eteri benzilici in acetali mediante catalisi di titanocene(III) in singoli passaggi di elettroni calcolati a livello PW6B95-D4/def2-QZVP + COSMO-RS(THF)// PBEh-3c/DCOSMO-RS(THF). I valori tra parentesi sono calcolati per il catalizzatore Cp2TiCl. Angewandte Chemie, DOI:10.1002/anie.202013561
Catalisi basata sul modello della natura
Per raggiungere questo obiettivo è necessario un catalizzatore adatto. In senso figurato, gli atomi di ossigeno hanno due "braccia" con cui possono formare legami. Se l'anello epossidico si rompe, uno di questi bracci diventa libero. Il catalizzatore ora si lega ad esso temporaneamente. Questo avvia una sequenza di riarrangiamenti interni alla molecola (intramolecolari). Alla fine di questa sequenza, l'atomo di ossigeno rilascia nuovamente il catalizzatore e si lega invece al carbonio desiderato. "Questo passaggio si chiama rimbalzo dell'ossigeno, "dice Gansäuer.
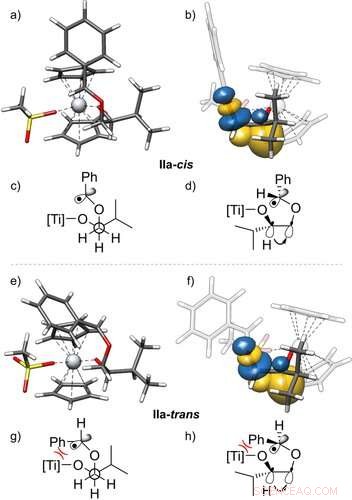
Strutture 3D dei radicali IIa-cis (a, b) e IIa-trans (e, f) e la loro stabilizzazione mediante interazioni gauche, con vista laterale. Gli orbitali di legame naturale (NBO)23 mostrati sono ottenuti da un calcolo PBEh-3c+CPCM(THF). Inoltre le proiezioni di Newman (c, g) e strutture a cuneo e trattino (d, h) di questi radicali sono dati. Mostrano l'orbitale del legame C-H che dona nell'orbitale σ* del legame C-O, visualizzare l'effetto gauche. Viene mostrata solo una delle due interazioni gauche efficaci. Valore isosuperficie=0.05 e−1/2 bohr−3/2. Angewandte Chemie, DOI:10.1002/anie.202013561
Questo meccanismo è stato usato raramente nelle sintesi chimiche fino ad oggi, piuttosto diversamente in natura:il fegato, Per esempio, utilizza il "rimbalzo dell'ossigeno" per abbattere le tossine. Ciò richiede anche catalizzatori, i cosiddetti enzimi P450. Il loro centro attivo contiene un atomo di ferro. "Il cuore del nostro catalizzatore è costituito anche da un metallo comune e non tossico, vale a dire titanio, " spiega il Prof. Dr. Stefan Grimme dell'Istituto di Chimica Fisica e Teorica dell'Università di Bonn.
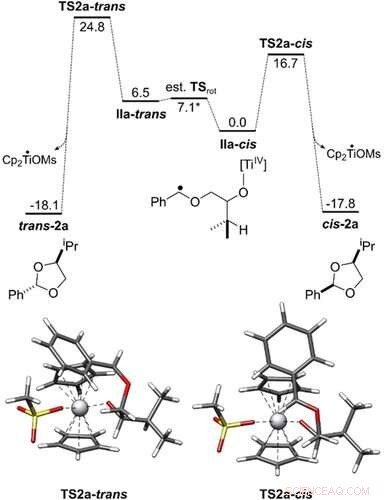
Profilo energetico della conversione di IIa-cis e IIa-trans in cis-2 a e trans-2 a. Tutte le energie libere di Gibbs sono mostrate in kcal mol−1. Le geometrie dello stato di transizione sono state ottenute con PBEh-3c/COSMO(THF). Il ciclo catalitico è stato studiato a livello teorico PW6B95-D4/def2-QZVP + COSMO-RS(THF)// PBEh-3c/ COSMO(THF). Angewandte Chemie, DOI:10.1002/anie.202013561
Sintonizzazione del catalizzatore sul computer
Durante la sintesi dell'acetale, il titanio prima assorbe un atomo di ossigeno e poi lo rilascia nuovamente (all'ossidazione segue una cosiddetta riduzione). Funziona efficacemente solo se lega l'ossigeno a se stesso abbastanza forte senza "aggrapparsi" troppo. Per regolare adeguatamente la sua affinità per l'ossigeno, il titanio è legato a determinate molecole, suoi ligandi. A seconda del partner vincolante, il metallo ha quindi un effetto ossidante un po' più forte o può essere ridotto più facilmente. Le "molecole di sintonia" più adatte vengono oggi selezionate con l'ausilio di un computer. Il gruppo di ricerca attorno al Prof. Grimme è specializzato in questo compito:negli ultimi anni, ha sviluppato algoritmi che consentono simulazioni molto veloci delle proprietà dei catalizzatori.
Ciò ha consentito ai ricercatori nel loro studio di ottimizzare il catalizzatore in modo che converta completamente il materiale di partenza nell'acetale desiderato. "Il risultato documenta molto bene quanto sia utile una stretta collaborazione tra esperimento e teoria per lo sviluppo di metodi di catalisi sostenibili, "dice Gansäuer.