I ricercatori dell'Università del Michigan stanno festeggiando la scoperta di una nuova biochimica vegetale e della sua insolita capacità di formare peptidi ciclici, molecole promettenti in campo farmaceutico poiché possono legarsi a bersagli farmacologici impegnativi.
I peptidi ciclici rappresentano un'area emergente e promettente della ricerca sui farmaci.
Il nuovo studio, condotto dai ricercatori Lisa Mydy e Roland Kersten dell’UM College of Pharmacy, ha rivelato un meccanismo attraverso il quale le piante generano peptidi ciclici. La ricerca è pubblicata sulla rivista Nature Chemical Biology .
Mydy ha identificato il nuovo ripiegamento proteico vegetale e la sua nuova chimica, che secondo lei non erano mai state viste prima. La proteina può generare peptidi ciclici, uno dei quali ha un potenziale come farmaco antitumorale.
"È estremamente emozionante", ha detto Mydy, un ricercatore post-dottorato presso il Dipartimento di Chimica Farmaceutica. "Questo tipo di scoperta non avviene troppo spesso."
Mydy e colleghi hanno studiato la biosintesi di una classe di peptidi macrociclici presenti nelle piante e noti per il loro potenziale utilizzo come farmaci terapeutici. Hanno identificato un "nuovo affascinante ripiegamento proteico che ha un meccanismo davvero insolito per formare peptidi ciclici. Si tratta di una nuova biochimica che non avevamo mai visto prima", ha detto Mydy.
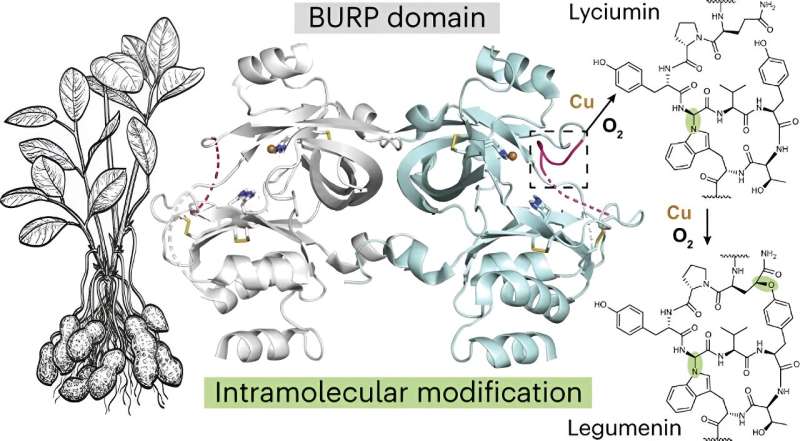
I ricercatori hanno anche esaminato la peptide ciclasi, una proteina chiamata AhyBURP trovata nelle radici della pianta di arachidi, un rappresentante della fondatrice Unknown Seed Protein, o tipo USP, che a sua volta fa parte della famiglia delle proteine del dominio BURP.
"Non c'erano informazioni sperimentali sulla nostra proteina AhyBURP", ha detto Mydy. "L'unico indizio che avevamo riguardo alla funzione era che la proteina aveva bisogno del rame per ciclizzare un peptide."
Il gruppo di ricerca ha studiato le strutture proteiche con la cristallografia a raggi X e ha utilizzato l'Advanced Photon Source presso l'Argonne National Laboratory. Nel processo, hanno scoperto che "la proteina AhyBURP utilizza rame e ossigeno in un modo unico che stiamo ancora studiando", ha detto Mydy.
"La maggior parte dei peptidi ciclici hanno bisogno di un altro enzima per entrare e fare la chimica della ciclizzazione", ha detto. "Tuttavia, AhyBURP può farlo all'interno della stessa proteina su se stessa. Altre proteine rame-dipendenti funzionano attaccando l'ossigeno da qualche parte sul peptide. Non lo osserviamo e vogliamo sapere perché. Lo vedo come il primo esempio di questo tipo di chimica che può verificarsi con il rame e l'ossigeno all'interno di una proteina."
La scoperta della nuova proteina è nata dal lavoro in corso nel laboratorio di Kersten. Nell'ambito della UM Natural Product Discovery Initiative, il laboratorio Kersten mira a scoprire e ricercare nuove sostanze chimiche di origine vegetale che possano diventare farmaci e, in definitiva, curare le malattie umane.
"Utilizziamo un approccio moderno in cui esaminiamo le sequenze genetiche delle piante, alla ricerca di geni collegati alla nuova chimica", ha affermato Kersten, assistente professore di chimica medicinale presso il College of Pharmacy. "È così che abbiamo identificato i prodotti peptidici ciclici e le proteine sottostanti come bersaglio di interesse."
Questa classe di peptidi è interessante perché le loro proprietà di ciclizzazione li rendono più strutturati e stabili, aumentandone il potenziale per l'uso come farmaci.
Molti farmaci, comprese le sostanze chimiche derivate da organismi viventi, sono ciclici, nel senso che possono legarsi ai bersagli farmacologici e rimanere intatti nel paziente per il tempo desiderato. La natura ha sviluppato molte soluzioni biochimiche per produrre tali molecole cicliche.
Kersten ha isolato altri composti prodotti dalla stessa famiglia di proteine che hanno dimostrato di avere effetti soppressivi sulle cellule del cancro del polmone nei test di laboratorio, quindi c'è una crescente speranza che questa scoperta abbia un potenziale come futuro agente antitumorale.
"Ora che sappiamo come appare la proteina per una delle proteine del dominio BURP, possiamo testare più idee su come la proteina possa influenzare la reazione chimica tra il peptide, il rame e l'ossigeno per formare peptidi ciclici", ha detto Mydy, un biologo strutturale ed enzimologo di formazione.
"È un enigma fantastico e stimolante capire il motivo per cui ciò sta accadendo e comprenderne la struttura. È estremamente entusiasmante far parte di questo tipo di scoperta che potrebbe eventualmente portare a terapie farmaceutiche efficaci."
Ulteriori informazioni: Lisa S. Mydy et al, Una macrociclasi intramolecolare nella biosintesi dei peptidi ribosomiali delle piante, Nature Chemical Biology (2024). DOI:10.1038/s41589-024-01552-1
Fornito dall'Università del Michigan