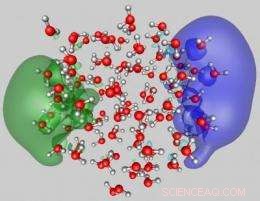
Questa immagine mostra la modalità di attacco superficiale di due elettroni in eccesso a un cluster di acqua (diametro medio vicino a 2 nm) composto da 105 molecole. La configurazione mostrata è stata ottenuta da simulazioni quantistiche di principi primi. Le due funzioni d'onda occupate ciascuna da un elettrone in eccesso, raffigurato in blu e verde, sono localizzati ai lati opposti del cluster e sono mostrati sovrapposti alle molecole d'acqua. Gli ossigeni e gli idrogeni delle molecole d'acqua sono rappresentati da sfere rosse e grigie, rispettivamente. Credito:Uzi Landman/Georgia Tech
Gli scienziati hanno scoperto le fasi fondamentali del caricamento di goccioline d'acqua di dimensioni nanometriche e hanno svelato il meccanismo a lungo ricercato dell'emissione di idrogeno dall'acqua irradiata. Lavorando insieme al Georgia Institute of Technology e all'Università di Tel Aviv, gli scienziati hanno scoperto quando il numero di molecole d'acqua in un cluster supera 83, due elettroni in eccesso possono attaccarsi ad esso - formando dielettroni - rendendolo una nano gocciolina doppiamente carica negativa. Per di più, gli scienziati hanno trovato prove sperimentali e teoriche che nelle goccioline composte da 105 molecole o più, i dielettroni in eccesso partecipano a un processo di scissione dell'acqua con conseguente liberazione di idrogeno molecolare e formazione di due anioni idrossido solvatati. I risultati appaiono nel numero del 30 giugno del Journal of Physical Chemistry A .
È noto fin dai primi anni '80 che mentre i singoli elettroni possono legarsi a piccoli gruppi di acqua contenenti solo due molecole, solo ammassi molto più grandi possono attaccare più di singoli elettroni. Taglia selezionata, multi-elettrone, fino ad ora non sono stati osservati ammassi d'acqua caricati negativamente.
La comprensione della natura degli elettroni in eccesso nell'acqua ha catturato l'attenzione degli scienziati per più di mezzo secolo, e gli elettroni idrati sono noti per apparire come importanti reagenti nelle reazioni acquose indotte dalla carica e nei processi biologici molecolari. Inoltre, dalla scoperta nei primi anni '60 che l'esposizione dell'acqua alle radiazioni ionizzanti provoca l'emissione di idrogeno molecolare gassoso, gli scienziati sono rimasti perplessi dal meccanismo alla base di questo processo. Dopotutto, i legami nelle molecole d'acqua che trattengono gli atomi di idrogeno con gli atomi di ossigeno sono molto forti. La reazione di evoluzione dell'idrogeno del dielettrone (DEHE), che produce gas idrogeno e anioni idrossido, possono svolgere un ruolo nelle reazioni indotte dalle radiazioni con il DNA ossidato che hanno dimostrato di essere alla base della mutagenesi, cancro e altre malattie.
"L'attaccamento di più elettroni alle goccioline d'acqua è controllato da un sottile atto di bilanciamento tra le forze che legano gli elettroni alle molecole d'acqua polari e la forte repulsione tra gli elettroni carichi negativamente, " disse Uzi Landman, Reggenti e Professore di Istituto di Fisica, F.E. Callaway Chair e direttore del Center for Computational Materials Science (CCMS) presso la Georgia Tech.
"Inoltre, il legame di un elettrone al cluster disturba gli accordi di equilibrio tra le molecole d'acqua legate all'idrogeno e anche questo deve essere controbilanciato dalle forze attrattive di legame. Per calcolare il modello e la forza della carica a uno e due elettroni di goccioline d'acqua di dimensioni nanometriche, abbiamo sviluppato e impiegato simulazioni di dinamica molecolare quantistica meccanica di prim'ordine che vanno ben oltre quelle che sono state utilizzate in questo campo, " Ha aggiunto.
Le indagini su cluster selezionati di dimensioni controllate consentono l'esplorazione delle proprietà intrinseche di aggregati di materiali di dimensioni finite, oltre a sondare l'evoluzione dipendente dalle dimensioni delle proprietà dei materiali dalla nanoscala molecolare al regime di fase condensata.
Negli anni '80 Landman, insieme ai ricercatori senior del CCMS Robert Barnett, il compianto Charles Cleveland e Joshua Jortner, professore di chimica all'Università di Tel Aviv, scoperto che ci sono due modi in cui i singoli elettroni in eccesso possono attaccarsi ai gruppi d'acqua:uno in cui si legano alla superficie della goccia d'acqua, e l'altro dove si localizzano in una cavità all'interno della gocciolina, come nel caso dell'acqua sfusa. Successivamente, uomo di terra, Barnett e lo studente laureato Harri-Pekka Kaukonen hanno riferito nel 1992 di indagini teoriche riguardanti l'attaccamento di due elettroni in eccesso ai cluster di acqua. Hanno previsto che tale doppia carica si sarebbe verificata solo per nano-goccioline sufficientemente grandi. Hanno anche commentato la possibile reazione di evoluzione dell'idrogeno. Da allora non è stato seguito nessun altro lavoro sulla carica di elettroni delle goccioline d'acqua.
Cioè fino a poco tempo fa, quando Landman, ora uno dei leader mondiali nel settore dei cluster e delle nanoscienze, e Barnett ha collaborato con Ori Chesnovsky, professore di chimica, e ricercatore associato Rina Giniger presso l'Università di Tel Aviv, in un progetto congiunto volto a comprendere il processo di carica dielettroni dei cluster d'acqua e il meccanismo della reazione che ne consegue - che non è stato osservato in precedenza in esperimenti su gocce d'acqua. Utilizzando su larga scala, simulazioni dinamiche di prim'ordine all'avanguardia, developed at the CCMS, with all valence and excess electrons treated quantum mechanically and equipped with a newly constructed high-resolution time-of-flight mass spectrometer, the researchers unveiled the intricate physical processes that govern the fundamental dielectron charging processes of microscopic water droplets and the detailed mechanism of the water-splitting reaction induced by double charging.
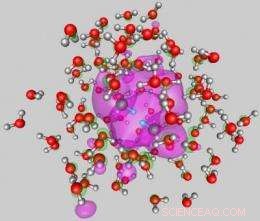
This image shows the internal attachment mode of two electrons to a water cluster (average diameter of close to 2nm) comprised of 105 molecules. The shown configuration was obtained from first-principles quantum simulations. The wave function of the two excess electrons is depicted in pink and it is shown superimposed on the water molecules of the cluster. The compact dielectron distribution is localized in a hydration cavity in the interior of the cluster. The configuration shown here corresponds to the start of the dielectron hydrogen-evolution reaction. The protons of the two reacting neighboring water molecules, located approximately in the middle of the figure, are depicted by smaller blue spheres. Together with the dielectron these protons would form, in the course of the reaction, a hydrogen molecule. The oxygens and hydrogens of the water molecules are represented by red and gray spheres, rispettivamente. Credit:Uzi Landman/Georgia Tech
The mass spectrometric measurements, performed at Tel Aviv, revealed that singly charged clusters were formed in the size range of six to more than a couple of hundred water molecules. Però, for clusters containing more than a critical size of 83 molecules, doubly charged clusters with two attached excess electrons were detected for the first time. Most significantly, for clusters with 105 or more water molecules, the mass spectra provided direct evidence for the loss of a single hydrogen molecule from the doubly charged clusters.
The theoretical analysis demonstrated two dominant attachment modes of dielectrons to water clusters. The first is a surface mode (SS'), where the two repelling electrons reside in antipodal sites on the surface of the cluster (see the two wave functions, depicted in green and blue, in Figure 1). The second is another attachment mode with both electrons occupying a wave function localized in a hydration cavity in the interior of the cluster the so-called II binding mode (see wave function depicted in pink in Figure 2). While both dielectron attachment modes may be found for clusters with 105 molecules and larger ones, only the SS' mode is stable for doubly charged smaller clusters.
"Moreover, starting from the II, internal cavity attachment mode in a cluster comprised of 105 water molecules, our quantum dynamical simulations showed that the concerted approach of two protons from two neighboring water molecules located on the first shell of the internal hydration cavity, leads, in association with the cavity-localized excess dielectron (see Figure 2), to the formation of a hydrogen molecule. The two remnant hydroxide anions diffuse away via a sequence of proton shuttle processes, ultimately solvating near the surface region of the cluster, while the hydrogen molecule evaporates, " said Landman.
"Cosa c'è di più, in addition to uncovering the microscopic reaction pathway, the mechanism which we discovered requires initial proximity of the two reacting water molecules and the excess dielectron. This can happen only for the II internal cavity attachment mode. Di conseguenza, the theory predicts, in agreement with the experiments, that the reaction would be impeded in clusters with less than 105 molecules where the II mode is energetically highly improbable. Ora, that's a nice consistency check on the theory, " Ha aggiunto.
As for future plans, Landman remarked, "While I believe that our work sets methodological and conceptual benchmarks for studies in this area, there is a lot left to be done. Per esempio, while our calculated values for the excess single electron detachment energies are found to be in quantitative agreement with photoelectron measurements in a broad range of water cluster sizes containing from 15 to 105 molecules providing a consistent interpretation of these measurements, we would like to obtain experimental data on excess dielectron detachment energies to compare with our predicted values, " Egli ha detto.
"Additionally, we would like to know more about the effects of preparation conditions on the properties of multiply charged water clusters. We also need to understand the temperature dependence of the dielectron attachment modes, the influence of metal impurities, and possibly get data from time-resolved measurements. The understanding that we gained in this experiment about charge-induced water splitting may guide our research into artificial photosynthetic systems, as well as the mechanisms of certain bio-molecular processes and perhaps some atmospheric phenomena."
"You know, " he added. "We started working on excess electrons in water clusters quite early, in the 1980s close to 25 years ago. If we are to make future progress in this area, it will have to happen faster than that."