Mirare ai tumori maligni con elevata precisione è una sfida per i ricercatori biomedici. Tuttavia, è probabile che questo scenario assista a un cambiamento di paradigma nel prossimo futuro attraverso l'uso di batteri appositamente progettati in grado di eliminare le cellule maligne in modo efficiente.
L’uso dei batteri per colpire le cellule tumorali, o la terapia batterica, può essere ulteriormente migliorato attraverso l’ingegneria genetica e la nanotecnologia. Tuttavia, la sua efficacia potrebbe essere ostacolata da vincoli tecnici e dal potenziale sviluppo di resistenza agli antibiotici. Pertanto, è fondamentale ottenere una modifica chimica moderata ma efficace dei batteri per migliorarne la biocompatibilità e la funzionalità, in modo tale che le loro capacità mediche non siano compromesse.
Recentemente, alcuni tipi di batteri fotosintetici viola (PPSB) sono venuti alla ribalta per il loro potenziale nell’affrontare le sfide della terapia batterica. Esplorando ulteriormente questo aspetto, i ricercatori hanno pubblicato uno studio su Nano Today che riporta l'uso di PPSB chimicamente modificato per rilevare ed eliminare cellule cancerose difficili da sradicare in un modello murino.
Lo studio, condotto dal professore associato Eijiro Miyako del Japan Advanced Institute of Science and Technology (JAIST), ha selezionato Rhodopseudomonas palustris (RP) come batterio ottimale per condurre gli studi. "L'RP ha dimostrato proprietà eccellenti, come la fluorescenza nel vicino infrarosso (NIR), la conversione fototermica e la bassa citotossicità. Assorbe la luce NIR e produce radicali liberi, una proprietà che può essere utilizzata per uccidere le cellule tumorali", spiega il Prof. Miyako.
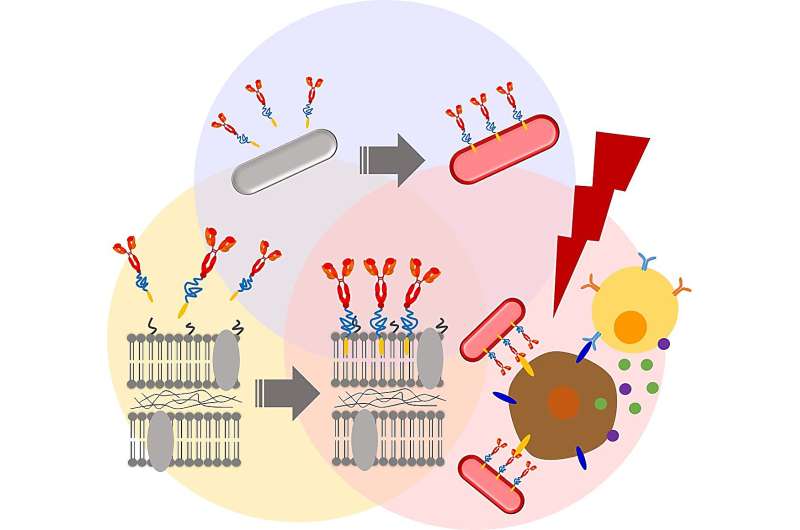
Nel tentativo di migliorare l'efficacia terapeutica del ceppo isolato, il team ha cercato modifiche chimiche per alterare le membrane batteriche. Innanzitutto, hanno eseguito la PEGilazione della membrana, ovvero l'attacco di derivati del polietilenglicole alle pareti cellulari batteriche. Ricerche precedenti indicano che la PEGilazione batterica aiuta a eludere la risposta immunitaria dell'ospite e converte l'energia luminosa in calore, che può quindi essere utilizzato per eliminare selettivamente le cellule cancerose.
I primi risultati sono stati incoraggianti. Ad esempio, il rivestimento della superficie della membrana RP con un ancoraggio biocompatibile per membrana (BAM) non ha influito negativamente sulla vitalità delle cellule RP per almeno una settimana. Inoltre, gli RP funzionalizzati con BAM non sono stati eliminati tramite fagocitosi da parte dei macrofagi, cellule che svolgono un ruolo chiave nelle azioni difensive del sistema immunitario contro le invasioni batteriche.
Successivamente, i ricercatori hanno collegato un coniugato fluorescente Alexa488-BSA agli RP funzionalizzati con BAM, creando così un complesso batterico con un marcatore fluorescente tracciabile. Questo coniugato è stato successivamente sostituito con un anticorpo PD-L1. Studi precedenti hanno dimostrato che le cellule tumorali esprimono una proteina chiamata Programmed Cell Death Ligand 1 (PD-L1) sulla loro superficie. PD-L1 può disattivare facilmente il sistema di difesa dell'ospite legandosi ai recettori PD-1. Ciò consente alle cellule tumorali di eludere il rilevamento e l’eliminazione del sistema immunitario. Gli anticorpi anti-PD-L1 bloccano questa interazione, impedendo così alle cellule tumorali di aggirare la distruzione mediata dal sistema immunitario.
Come previsto, sia l’anti-PD-L1-BAM-RP che l’RP hanno inibito la crescita del tumore in un modello murino di cancro del colon. Tuttavia, gli anti-PD-L1–BAM–RP, BAM–RP e RP, quando eccitati con un laser, hanno mostrato un effetto antitumorale particolarmente drammatico. Infatti, i tumori solidi sono scomparsi completamente dopo l’irradiazione laser di anti-PD-L1–BAM–RP, BAM–RP o RP iniettati in topi portatori di tumore. Inoltre, nella valutazione delle proprietà di conversione fototermica, sia l'anti-PD-L1–BAM–RP che l'RP naturale hanno mostrato una forte conversione fototermica dovuta alla presenza di molecole di batterioclorofilla (BChl) guidate dalla luce.
Tra i vari bioconiugati, gli anti-PD-L1–BAM–RP hanno mostrato la massima efficacia nella fase iniziale del trattamento. Inoltre, non era tossico per le cellule sane circostanti o per l'ospite murino. Esperimenti successivi hanno rivelato il meccanismo alla base dell'annichilazione del tumore del colon nel modello murino.
"I nostri risultati hanno rivelato che i batteri funzionali guidati dalla luce hanno dimostrato efficaci funzioni ottiche e immunologiche nel modello murino di cancro al colon. Inoltre, la fluorescenza NIR dei complessi batterici ingegnerizzati è stata utilizzata per localizzare i tumori, aprendo di fatto la strada per la futura traduzione clinica," dice il Prof. Miyako.
Aggiunge inoltre:"Crediamo che questa tecnologia batterica potrebbe essere disponibile per sperimentazioni cliniche entro 10 anni e avere implicazioni positive per la diagnosi e la terapia del cancro."
Ulteriori informazioni: Sheethal Reghu et al, Immunoteranostici contro il cancro che utilizzano complessi batterici fotosintetici nanoattivi bioattivi rivestiti, Nano Today (2023). DOI:10.1016/j.nantod.2023.101966
Informazioni sul giornale: Nano oggi
Fornito dall'Istituto avanzato giapponese di scienza e tecnologia