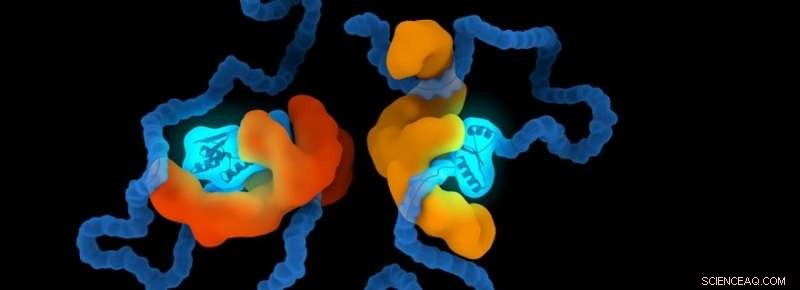
Credito:Università di Leiden
Gli chaperon sono un insieme di proteine specializzate per assistere le proteine nel corpo umano. Aiutano le proteine a piegarsi nella forma giusta e le proteggono dall'adattamento di forme sbagliate. Il gruppo di ricerca di Alireza Mashaghi, assistente professore e ricercatore principale presso LACDR, indaga su queste strutture. Vahid Satarifard, studente laureato nel gruppo di ricerca:"Più di cinquanta malattie sono state identificate come associate al misfolding proteico. Molte di esse sono altamente devastanti e sempre più diffuse". Nelle malattie proteopatiche, le proteine possono ripiegarsi in modo sbagliato, diventando strutturalmente anormale. Questo li fa diventare tossici o perdono la loro normale funzione.
Non è ben compreso come gli chaperon aiutino altre molecole. È stato suggerito che gli chaperon si leghino alle proteine e questo guidi il loro ripiegamento. Mashaghi:"È noto che gli chaperon impongono un vincolo alle proteine dei loro clienti, ma se tali vincoli hanno implicazioni per il ripiegamento delle proteine è una questione aperta. Alcuni chaperon entrano in contatto con i polipeptidi dei loro clienti e li confinano internamente; altri abbracciano i loro clienti e li confinano esternamente. Abbiamo dimostrato che questi confinamenti possono effettivamente influenzare il processo di piegatura. Alcune forme sono meno occupate mentre altre si formano con una maggiore probabilità. Abbiamo identificato le regole che governano questo processo". Queste regole mostrano la probabilità che una proteina assuma una certa forma sotto un dato vincolo.
Trattare con le forme
Mashaghi:"Ci siamo chiesti se possiamo definire la topologia per una molecola lineare come una proteina o il DNA. La topologia si occupa delle forme. Un'idea centrale in questo campo è che se prendi un oggetto e lo deformi continuamente, le caratteristiche topologiche non cambiano, ma la deformazione discontinua come la rottura di un oggetto ne cambia la topologia."
Mashaghi ha un background in biofisica. "Tirare due estremità di varie proteine e frammenti di DNA è molto simile a tirare una corda. Per le corde, la teoria dei nodi funge da quadro standard per la definizione delle forme. Quello che noi e altri ricercatori abbiamo capito è che più del 97 percento delle nostre proteine non formano un nodo quando le tiri e quindi cadono in una classe di forma, vale a dire il "nodo".
Primo, il team di ricerca ha simulato una catena polimerica confinata all'interno di una sfera. Quindi, hanno studiato come questo vincolo può influenzare la struttura. Satarifard:"In questo studio abbiamo utilizzato modelli polimerici consolidati con una nuova struttura, concentrandosi sulla forma piuttosto che sulla dimensione e sulle distanze. Questo quadro può fornire una nuova visione della struttura basata sulla disposizione dei contatti. Assumiamo che nei biopolimeri esistano circuiti simili, che sarebbe piuttosto flessibile in alcune condizioni."
Simulazione di una biomolecola
Il team di ricerca ha anche confrontato le forme di una catena non vincolata con quando è vincolata esternamente o internamente da un'altra molecola. Maziar Heidari, uno dei dottorandi, afferma:"Questo è importante in biologia perché la funzionalità di una biomolecola è in gran parte determinata dalla sua forma. Ad esempio, il modo in cui una proteina è piegata e nasconde i suoi siti di legame può influenzare le sue funzionalità e interazioni con le altre proteine".
Il team di ricerca ha osservato che la forma interna e l'organizzazione della piegatura cambiano sostanzialmente quando la catena subisce diversi livelli di confinamento. Heidari:"Questo è interessante perché mette in luce la funzionalità e la dinamica dei possibili meccanismi e percorsi attraverso i quali una molecola esterna come un chaperone si piega e confina le sue molecole client. Inoltre, i nostri risultati non si limitano allo studio delle molecole biologiche esistenti. I nostri risultati possono ispirare altri scienziati a progettare una molecola artificiale o un farmaco che prenda di mira i processi di ripiegamento delle proteine o del genoma".