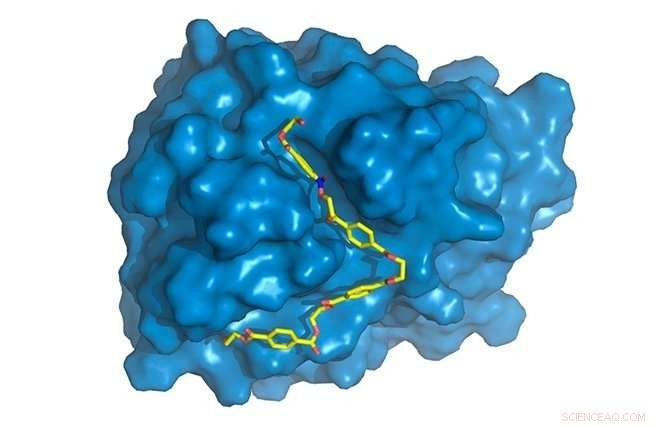
PETase è mostrato in blu, con catena PET (gialla) legata al sito attivo, dove sarà degradato. Credito:Rodrigo Leandro Silveira
Da quando è stato scoperto, l'enzima noto come PETase ha riscosso un grande interesse scientifico per la sua capacità di digerire il PET (polietilentereftalato).
Un polimero utilizzato principalmente per fabbricare bottiglie per bevande (ma anche abbigliamento, tappeti, e altri prodotti), Il PET ha lo svantaggio di resistere alla degradazione. Bottiglie e altri oggetti in PET (polietilene tereftalato) impiegano almeno 800 anni per biodegradarsi nelle discariche o in mare. Ogni anno vengono scaricati negli oceani tra i 4,8 e i 12,7 miliardi di chilogrammi di plastica.
Uno studio con risultati pubblicati di recente sulla rivista Atti dell'Accademia Nazionale delle Scienze ( PNAS ) ha mostrato come un team internazionale di collaboratori è riuscito a potenziare la capacità di PETase di scomporre la plastica.
"Nel nostro progetto di ricerca, abbiamo caratterizzato la struttura tridimensionale dell'enzima in grado di digerire questa plastica, progettato per aumentare la sua capacità di degradazione, e dimostrato che agisce anche sul polietilene-2, 5-furandicarbossilato (PEF), un sostituto del PET ottenuto da materie prime rinnovabili, " ha detto il co-autore Rodrigo Leandro Silveira, un borsista post-dottorato presso l'Istituto di chimica dell'Università di Campinas (IQ-UNICAMP).
Un batterio che sopravvive metabolizzando il PET
L'interesse per la PETase è sorto nel 2016, quando un gruppo di ricercatori giapponesi guidati da Shosuke Yoshida identificò una nuova specie di batterio, Ideonella sakaiensis, che può nutrirsi di PET utilizzandolo come fonte di carbonio ed energia. Il batterio rimane l'unico organismo conosciuto con questa capacità. Cresce letteralmente su PET.
"Oltre a identificare I. sakaiensis, gli scienziati giapponesi hanno scoperto che produce due enzimi e li secerne nell'ambiente, "Spiega Silveira. "Uno degli enzimi secreti è la PETase. Perché ha un certo grado di cristallinità, Il PET è un polimero molto difficile da scomporre. Ma la PETase lo attacca e lo scompone in piccole unità di acido mono(2-idrossietil)tereftalico, o MHET. Le unità di MHET vengono quindi convertite in acido tereftalico e assorbite e metabolizzate dal batterio".
I. Sakaiensis è l'unico organismo vivente noto per utilizzare una molecola sintetica prodotta dall'uomo per sopravvivere. Ciò significa che il batterio è il risultato di un processo evolutivo molto recente che si è sviluppato negli ultimi decenni. Il batterio si è adattato a un polimero che è stato sviluppato nei primi anni '40 e ha iniziato ad essere utilizzato su scala industriale solo negli anni '70. PETase è la chiave per capire come.
"PETase fa la parte più difficile, che sta scomponendo la struttura cristallina e depolimerizzando il PET in MHET, " ha affermato il ricercatore finanziato dalla FAPESP. "Il lavoro svolto dal secondo enzima, che converte il MHET in acido tereftalico, è molto più semplice, perché il suo substrato è costituito da monomeri a cui l'enzima può accedere facilmente perché dispersi nel mezzo di reazione. Per questa ragione, la ricerca si è concentrata sulla PETase."
L'enzima modificato si lega meglio al polimero
Il passo successivo è stato quello di studiare PETase in dettaglio, il contributo del nuovo progetto di ricerca. "Ci siamo concentrati sulla ricerca di cosa dia a PETase la capacità di fare qualcosa che altri enzimi non possono fare in modo molto efficiente. Abbiamo iniziato caratterizzando la struttura 3D di questa proteina, "Spiega Silveira.
"Ottenere la struttura 3D significa scoprire la x, coordinate y e z di ciascuna delle migliaia di atomi che compongono la macromolecola. I nostri colleghi britannici lo hanno fatto utilizzando una tecnica ben nota e ampiamente utilizzata chiamata diffrazione dei raggi X disponibile in un laboratorio molto simile a Sirius, ora in costruzione a Campinas."
Una volta ottenuta la struttura 3-D, i ricercatori hanno iniziato a confrontare la PETase con le proteine correlate. Il parente più prossimo è una cutinasi del batterio Thermobifida fusca che degrada la cutina, una sorta di vernice naturale che si trova sulle foglie delle piante. Alcuni microrganismi patogeni usano la cutinasi per abbattere la barriera della cutina e i nutrienti appropriati nelle foglie.
"Abbiamo trovato alcune differenze specifiche nella PETasi rispetto alla cutinasi nella regione dell'enzima in cui si verificano le reazioni chimiche, noto come sito attivo. PETase ha un sito attivo più aperto, Per esempio, " ha detto Silveira. "Abbiamo studiato i movimenti molecolari dell'enzima attraverso simulazioni al computer, la parte alla quale ho contribuito maggiormente. Mentre la struttura cristallina, ottenuta per diffrazione di raggi X, fornito informazioni statiche, le simulazioni ci hanno fornito informazioni dinamiche e ci hanno permesso di scoprire il ruolo specifico di ciascun amminoacido nel processo di degradazione del PET".
La fisica dei movimenti della molecola risulta dall'attrazione e repulsione elettrostatica di un gran numero di atomi e dalla temperatura. Le simulazioni al computer hanno consentito ai ricercatori di comprendere in modo più completo come la PETase si lega e interagisce con la PET.
"Abbiamo scoperto che la PETasi e la cutinasi hanno due diversi amminoacidi nel sito attivo. Abbiamo quindi utilizzato procedure di biologia molecolare per produrre mutazioni nella PETasi con l'obiettivo di convertirla in cutinasi, ", ha detto Silveira.
"Se potessimo farlo, scopriremmo quali componenti gli hanno conferito questa proprietà unica di degradare il PET. Però, con nostra sorpresa, quando abbiamo cercato di sopprimere questa particolare attività della PETasi, cercando di convertire la PETasi in cutinasi, abbiamo prodotto una PETasi ancora più attiva. Abbiamo cercato di ridurne l'attività, e invece l'abbiamo potenziata".
Sono state necessarie più simulazioni al computer per capire perché la PETasi mutante fosse migliore della PETasi originale. La modellazione e le simulazioni hanno mostrato chiaramente che le alterazioni prodotte nella PETase originale hanno facilitato il legame dell'enzima al substrato. Questo legame dipende sia dalla geometria, con due molecole che si incastrano come chiave e buco della serratura, e sui fattori termodinamici coinvolti nelle interazioni tra i vari componenti dell'enzima e del polimero. Il modo elegante per descrivere questo è che la PETasi modificata ha "maggiore affinità" per il substrato.
Per quanto riguarda l'ottenimento di un enzima in grado di digerire tonnellate di rifiuti di plastica, lo studio è stato un grande successo, ma perché PETase è PETase rimane un mistero.