
Il team del Cluster of Excellence Resolv ha studiato la chimica nello spazio interstellare. Credito: RUB, Lehrstuhl für Astrophysik
Un gruppo di ricerca della Ruhr-Universität Bochum ha studiato come gli acidi interagiscono con le molecole d'acqua a temperature estremamente basse. Utilizzando analisi spettroscopiche e simulazioni al computer, hanno studiato la questione se l'acido cloridrico (HCl) rilascia o meno il suo protone in condizioni come quelle che si trovano nello spazio interstellare. La risposta dipende dall'ordine in cui le molecole di acqua e acido cloridrico si uniscono.
Il gruppo guidato dalla professoressa Martina Havenith, Cattedra di Chimica Fisica II, e il professor Dominik Marx, Cattedra di Chimica Teorica, della Ruhr-Universität Bochum, insieme al team guidato dalla dott.ssa Britta Redlich della Radboud University, Nimega, descrive i risultati sulla rivista Progressi scientifici , pubblicato online in anticipo il 7 giugno 2019.
Capire come si sono formate le molecole complesse
Se l'acido cloridrico entra in contatto con molecole d'acqua in condizioni normali, come a temperatura ambiente, l'acido si dissocia immediatamente, rilasciando il suo protone (H+); rimane uno ione cloruro (Cl-). Il team di ricerca ha voluto scoprire se lo stesso processo avviene anche a temperature estremamente basse inferiori a 10 Kelvin, cioè., sotto meno 263,15 gradi Celsius. "Vorremmo sapere se la stessa chimica acido-alcalina che conosciamo sulla Terra esiste anche nelle condizioni estreme nello spazio interstellare, " spiega Martina Havenith, relatore per il Cluster di Eccellenza Resolv. "I risultati sono cruciali per comprendere come le molecole chimiche più complesse si siano formate nello spazio, molto prima dell'esistenza dei primi precursori della vita".
Per replicare le temperature estremamente basse in laboratorio, i ricercatori hanno condotto le reazioni chimiche in una gocciolina di elio superfluido. Hanno monitorato i processi utilizzando un tipo speciale di spettroscopia a infrarossi, in grado di rilevare vibrazioni molecolari a basse frequenze. Per questo i ricercatori hanno utilizzato un laser con una luminosità particolarmente elevata a Nimega. Le simulazioni al computer hanno consentito agli scienziati di interpretare i risultati sperimentali.
Primo, i ricercatori hanno aggiunto quattro molecole d'acqua, uno dopo l'altro, alla molecola di acido cloridrico. L'acido cloridrico si è dissociato durante questo processo, donando il suo protone a una molecola d'acqua, con conseguente ione idronio. Il restante ione cloruro, lo ione idronio e le altre tre molecole d'acqua formavano un ammasso.
Però, se i ricercatori hanno prima creato un ammasso simile al ghiaccio dalle quattro molecole d'acqua e poi hanno aggiunto l'acido cloridrico, hanno dato un risultato diverso:la molecola di acido cloridrico non si è dissociata; il protone è rimasto legato allo ione cloruro.
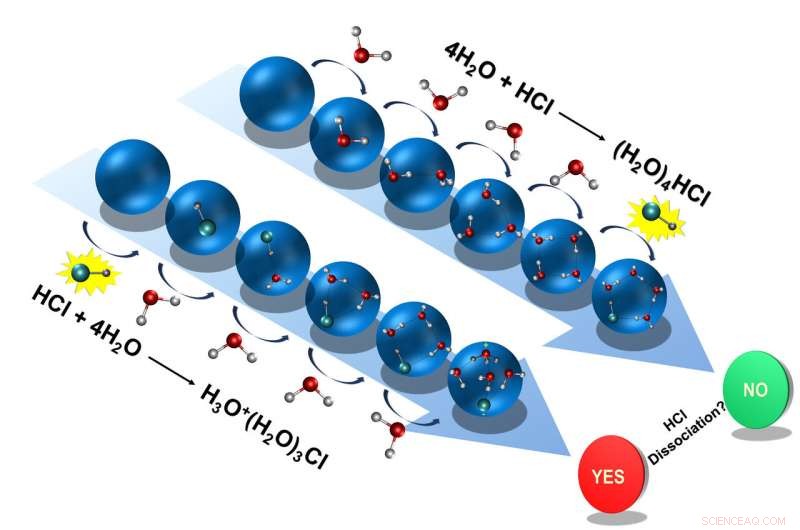
I due possibili percorsi che l'acido muriatico può seguire in condizioni come quelle che si trovano nello spazio interstellare:Dissociarsi o assorbire in acqua ghiacciata. Credito:D. Mani
"Nelle condizioni che si possono trovare nello spazio interstellare, gli acidi sono così in grado di dissociarsi, ma questo non deve necessariamente accadere:entrambi i processi sono due facce della stessa medaglia, per così dire, "dice Martina Havenith.
La chimica nello spazio non è semplice
I ricercatori hanno ipotizzato che il risultato possa essere applicato anche ad altri acidi, in quanto rappresenta il principio base della chimica in condizioni ultrafredde.
"La chimica nello spazio non è affatto semplice; potrebbe anche essere più complessa della chimica in condizioni planetarie, " dice Dominik Marx. Dopo tutto, dipende non solo dai rapporti di miscelazione delle sostanze reagenti ma anche dall'ordine in cui vengono aggiunte tra loro. "Questo fenomeno deve essere preso in considerazione in futuri esperimenti e simulazioni in condizioni ultrafredde, "dice il ricercatore.