
Un dispositivo microfluidico avanzato consente ai ricercatori di osservare contemporaneamente migliaia di singole cellule infettate da virus. Un primo piano del dispositivo mostra 18 pozzi, ciascuno contenente una singola cella. Credito:Cameron Lab, Penn State
Un nuovo miglioramento di un dispositivo lab-on-a-chip consente ai ricercatori di osservare contemporaneamente migliaia di singole cellule infettate da virus, fornendo importanti informazioni sulle dinamiche di infezione non disponibili con i metodi tradizionali.
Un team di ricercatori della Penn State e dell'Università del Texas ad Austin ha migliorato una versione precedente di un dispositivo microfluidico da loro sviluppato, aumentando notevolmente il numero di singole cellule che possono essere osservate contemporaneamente e rendendo possibile questo approccio unicellulare storicamente laborioso per lo screening dei farmaci. Un documento che descrive il dispositivo, che fornisce anche informazioni su come funzionano gli antivirali e se è probabile che un virus sviluppi resistenza, appare online il 30 ottobre, 2019 sulla rivista Progressi scientifici .
"I metodi tradizionali per studiare l'effetto di un antivirale sulle cellule infette si concentrano su una popolazione di molte cellule infette, " ha detto Craig Cameron, professore e titolare della Eberly Family Chair in Biochimica e Biologia Molecolare presso la Penn State al momento della ricerca e autore senior dell'articolo.
"Quando applichi un antivirale a un dosaggio particolare a una popolazione, puoi vedere quante cellule infette vengono uccise, o l'efficacia dell'antivirale. Ma le singole cellule possono rispondere in modo diverso a un farmaco, che possono avere importanti implicazioni per l'esito dell'infezione e la resistenza ai farmaci. Abbiamo precedentemente sviluppato un modo per studiare le singole cellule infette, e qui abbiamo adattato la tecnica per aumentare di dieci volte il numero di singole cellule che possiamo studiare contemporaneamente".
Il team utilizza un dispositivo microfluidico, un chip inciso con minuscoli canali, con circa 5700 singoli pozzetti, ognuno dei quali può essere riempito con singoli, cellule infette. Il loro dispositivo di prima generazione si basava su un metodo che lasciava la maggior parte dei pozzi vuoti. Ora, il team ha sviluppato una trappola fisica che hanno incorporato in uno degli strati del dispositivo, migliorare l'occupazione in modo che ora possano riempire circa il 90 percento dei pozzi.
"Altre persone hanno cercato di studiare le infezioni in singole cellule, ma devono aggiungere manualmente le cellule alle piastre da 96 o 384 pozzetti, " disse Wu Liu, un ricercatore post-dottorato alla Penn State al momento della ricerca che ha sviluppato la trappola. "Questo è noioso e richiede tempo. Con la nostra trappola e il dispositivo microfluidico, possiamo osservare più di 5000 singole cellule contemporaneamente."
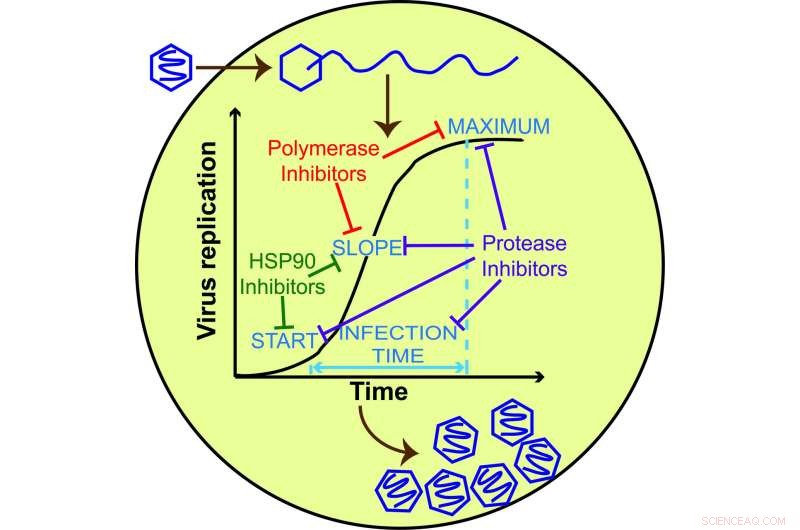
L'analisi di una singola cellula dei candidati antivirali rivela l'efficacia, meccanismo di azione, e, forse, probabilità di sviluppo di resistenza. Credito:Wu Liu, Craig E. Cameron
Per testare il dispositivo aggiornato, il team ha infettato le cellule con una versione modificata del poliovirus che produce una proteina fluorescente verde e ha monitorato la quantità di fluorescenza, che aumenta quando un virus si replica in una cellula, col tempo. Hanno anche applicato uno dei tre composti antivirali alle cellule infette. Questi composti sono noti per essere efficaci nel trattamento delle infezioni virali e operano attraverso meccanismi diversi, prendendo di mira diverse parti del virus o dell'host per impedire la replicazione del virus.
Il team di ricerca ha misurato cinque parametri per descrivere il decorso dell'infezione, incluso quando il virus ha iniziato a replicarsi, quanto velocemente si è replicato, e la quantità massima di crescita del virus, che insieme forniscono una firma dell'effetto del composto antivirale. Ciascuno dei tre composti aveva una firma diversa, che supporta l'idea che i composti con firme diverse possono operare in modi diversi. Confrontare la firma di un composto con quella di farmaci noti potrebbe aiutare a restringere l'obiettivo del farmaco, informazioni che richiedono una considerevole ricerca di follow-up dopo uno studio basato sulla popolazione.
"Durante lo sviluppo dei farmaci, potremmo creare una serie di composti diversi che sono strutturalmente simili a un promettente candidato farmaco antivirale, " disse Cameron. "Ora, confrontando le firme, possiamo determinare se questi analoghi agiscono sugli stessi bersagli e confrontarli con farmaci noti per essere sicuri".
Utilizzando il dispositivo, i ricercatori possono anche dire se particolari membri di una popolazione virale sono suscettibili al trattamento e in quale fase del ciclo di vita del virus agisce il trattamento. Per esempio, una classe di farmaci sembra mirare ai membri più forti della popolazione virale, che riduce la probabilità che il virus sviluppi resistenza a un trattamento.
"Questo approccio unicellulare potrebbe essere utile anche per studiare combinazioni di antivirali, poiché ora possiamo vedere effetti diversi dalla semplice quantità complessiva di uccisioni, " ha detto Cameron. "Per esempio, una combinazione di farmaci potrebbe rallentare la velocità di replicazione del virus, che potrebbe dare al sistema immunitario dell'ospite il tempo di eliminare l'infezione. Non lo vedresti da un'analisi della popolazione."
Poiché possono fornire rapidamente così tante informazioni, il team spera che l'approccio a cellula singola integri, o forse anche sostituire, screening iniziali per i candidati alla droga. L'approccio può essere utilizzato anche per lo screening dei farmaci per qualsiasi malattia per la quale esiste un test cellulare che monitora un cambiamento nella fluorescenza.
"Il dispositivo è attualmente difficile da produrre, " ha detto Cameron, "quindi stiamo lavorando per renderlo più accessibile in modo che possa essere utilizzato da chiunque".