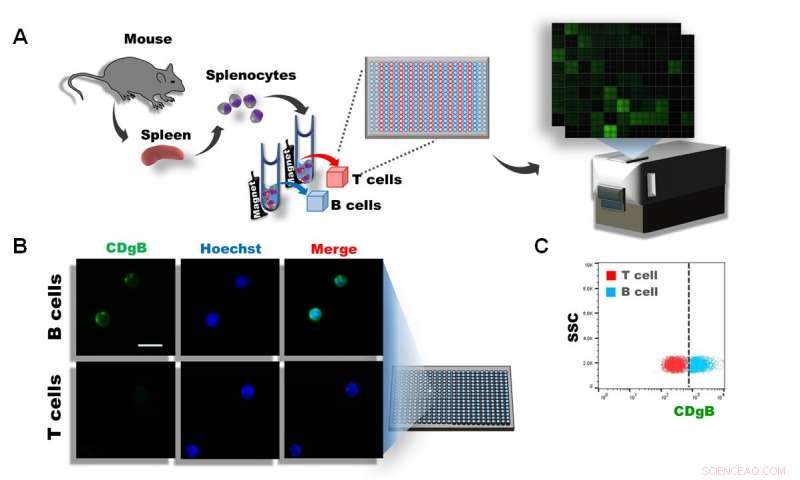
Figura 1. A) Gli splenociti sono stati isolati da milze di topo, e le cellule T e B sono state separate utilizzando l'ordinamento cellulare attivato magneticamente (MACS). Le cellule sono state successivamente piastrate in 384 pozzetti e oltre 10, 000 diverse molecole fluorescenti sono state esaminate utilizzando DOFLA. B) L'immagine al microscopio a fluorescenza mostra che CDgB colora le cellule B ma non le cellule T. C) Grafico di citometria a flusso della fluorescenza CDgB vs SSC tra popolazioni di cellule T e cellule B. Credito:Istituto per le scienze di base
Il sangue umano contiene diversi componenti, compreso il plasma, globuli rossi (RBC), globuli bianchi (globuli bianchi), e piastrine. Tra questi, I globuli bianchi sono suddivisi in numerose sottocategorie ciascuna con funzioni e caratteristiche uniche, come i linfociti, monociti, neutrofili, e altri. I linfociti sono ulteriormente suddivisi in linfociti T, linfociti B, e cellule NK. Distinguere e separare i diversi tipi di queste cellule è molto importante nella realizzazione di studi nel campo dell'immunologia.
La discriminazione di diversi tipi di cellule immunitarie viene in genere eseguita mediante citometria a flusso e smistamento cellulare attivato dalla fluorescenza (FACS), che possono identificare popolazioni distinte di cellule in base alla loro dimensione, granularità, e fluorescenza. Mentre le dimensioni e la granularità da sole non sono in grado di distinguere le cellule con parametri fisici simili, diversi tipi di cellule immunitarie mostrano una distinta combinazione di recettori immunitari sulle superfici cellulari. Per esempio, i linfociti T e i linfociti B esprimono CD3 e CD19, rispettivamente. Perciò, le cellule immunitarie che identificano la fluorescenza si sono basate sulla colorazione delle cellule utilizzando più anticorpi contro diversi recettori. È stato a lungo pensato che fosse impossibile distinguere diversi tipi di cellule immunitarie senza utilizzare questi anticorpi.
Però, nuova ricerca rivoluzionaria condotta dagli scienziati del Centro per l'autoassemblaggio e la complessità all'interno dell'Istituto per le scienze di base, Corea del Sud, potrebbe aver appena cambiato questo. I ricercatori hanno impiegato un approccio alla libreria di fluorescenza orientato alla diversità (DOFLA) per lo screening di oltre 10, 000 diverse molecole fluorescenti che utilizzano i linfociti B e T separati dalla milza di topo. Da questa, sono riusciti a scoprire una nuova sonda fluorescente in grado di discriminare i linfociti B rispetto ai linfociti T senza che il recettore cellulare prenda di mira gli anticorpi.
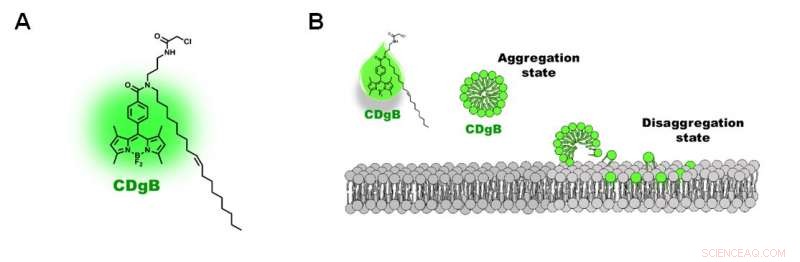
Figura 2. A) Struttura della molecola CDgB. B) CDgB libero non legato forma aggregati in soluzione, che si dissocia quando si legano alle membrane lipidiche. Credito:Istituto per le scienze di base
I ricercatori hanno chiamato la nuova sonda CDgB, che sta per Composto di Designazione verde per linfociti B. CDgB è una molecola lipofila che contiene un componente fluorescente attaccato a una catena idrocarburica. Poiché CDgB contiene sia un gruppo fluorescente polare che una coda di idrocarburi, significa che le molecole di colorante CDgB libere non legate formano aggregati simili alle micelle nella soluzione e mostrano un basso livello di fluorescenza di fondo. Quando si attaccano alle superfici cellulari, però, gli aggregati si dissociano e causano un picco nei segnali di fluorescenza. Inoltre, la natura lipofila del colorante significa che il colorante non si lega a un bersaglio proteico, e invece si localizza direttamente sulla struttura della membrana lipidica. Secondo i ricercatori, questo è stato "il primo esempio a segnalare questo tipo di meccanismo di distinzione cellulare".
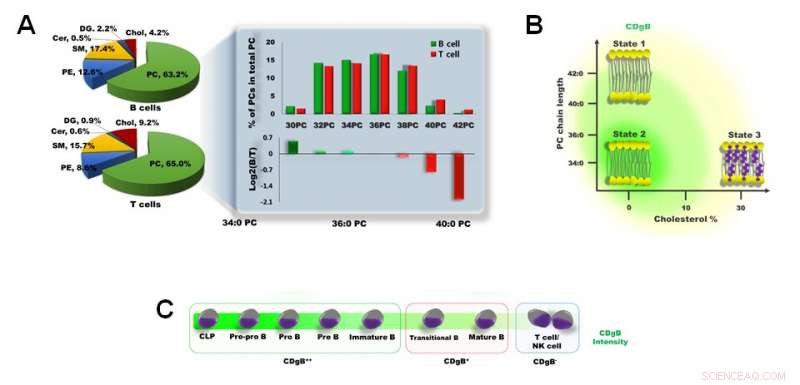
Figura 3. A) Differenza nella composizione lipidica di membrana tra cellule B e cellule T. B) CDgB colora selettivamente le membrane lipidiche delle cellule B che possiedono una catena di PC più corta e una minore percentuale di colesterolo. C) Il CDgB mostra una fluorescenza maggiore nelle cellule B immature (CDgB++) rispetto alle cellule B mature (CDgB+) o in altri linfociti (CDgB-). Credito:Istituto per le scienze di base
Il CDgB è in grado di indirizzare selettivamente le membrane cellulari dei linfociti B sui linfociti T o sulle cellule NK. I ricercatori hanno cercato di ottimizzare la selettività del CDgB testando diversi derivati delle molecole con varie lunghezze di catena di idrocarburi da 4 a 20 atomi di carbonio. È stato riscontrato che i derivati CDgB con 14-18 atomi di carbonio hanno mostrato la più alta selettività verso i linfociti B, con C18 che mostra i migliori risultati. È diventato più difficile distinguere le cellule attraverso la fluorescenza quando la lunghezza del carbonio è stata aumentata oltre 20. Il fatto che la lunghezza del carbonio sia importante nella selettività ha suggerito che il meccanismo dipendeva dalla differenza nelle strutture di membrana tra i linfociti B e T.
I ricercatori hanno ulteriormente chiarito questo meccanismo eseguendo l'analisi lipidomica delle membrane delle cellule B e T. La fosfatidilcolina (PC) costituisce la maggioranza (> 60%) dei fosfolipidi di membrana dei linfociti B e T. È stato scoperto che i linfociti B in generale avevano PC più corti di quelli dei linfociti T. Inoltre, il contenuto di colesterolo di membrana nei linfociti T era circa due volte superiore a quello dei linfociti B. Questi fattori conferiscono ai linfociti B una membrana cellulare più "flessibile", che si pensava fosse un fattore cruciale che spiega perché le molecole CDgB si attaccano più facilmente alle membrane cellulari dei linfociti B rispetto a quelle dei linfociti T. Anche tra i linfociti B, si è riscontrato che la forza della fluorescenza era diversa in base alla maturità cellulare. I progenitori delle cellule B e le cellule B immature emettono segnali di fluorescenza molto più luminosi rispetto alle cellule B mature, che è molto probabilmente dovuto alla maggiore flessibilità della membrana nelle cellule immature.
I ricercatori hanno inoltre concluso che questo nuovo meccanismo di distinzione delle cellule vive orientato ai lipidi (LOLD) può integrare il meccanismo di distinzione delle cellule esistente per migliorare la nostra capacità di distinguere tipi cellulari specifici da complicate miscele di cellule diverse. Questa ricerca è stata pubblicata su Giornale della Società Chimica Americana .