Credito:Yoshiko Nakagawa et al, Biologia chimica della natura (2022). DOI:10.1038/s41589-021-00951-y
In una scoperta che ha importanti ramificazioni per disturbi neurodegenerativi come il morbo di Alzheimer, i ricercatori RIKEN hanno scoperto come tre molecole chaperone nelle cellule di lievito lavorano insieme per rompere gli aggregati proteici fibrillari ricchi di foglietti beta noti come fibrille amiloidi.
Le proteine piegate nel modo sbagliato non possono svolgere correttamente il loro lavoro. Alcune proteine mal ripiegate note come prioni sono particolarmente insidiose perché trasmettono le loro forme distorte alle proteine che le circondano, che poi si uniscono per formare robuste zattere chiamate fibrille amiloidi. Le fibrille amiloidi sono state implicate in malattie da prioni (come il morbo di Creutzfeldt-Jakob), che sono sempre fatali, e malattie neurodegenerative come il morbo di Alzheimer e il morbo di Parkinson.
Il processo mediante il quale si formano le fibrille amiloidi ha ricevuto molta attenzione, ma si sa molto meno sul meccanismo mediante il quale vengono scomposte nelle cellule. Questo processo di disaggregazione è importante perché i frammenti che produce potrebbero consentire ai prioni di diffondersi tra le cellule.
"Molti ricercatori hanno studiato il meccanismo di formazione delle fibrille amiloidi, ma ci sono stati pochissimi studi sulla disaggregazione dell'amiloide", afferma Motomasa Tanaka del RIKEN Center for Brain Science. "Tuttavia, i piccoli frammenti proteici servono come semi per la formazione di fibrille amiloidi altrove, e il nostro lavoro precedente suggerisce che la disaggregazione dell'amiloide è in realtà più importante della crescita delle fibrille amiloidi".
Inoltre, sapere come si rompono le fibrille amiloidi potrebbe aiutare i ricercatori a sviluppare trattamenti per le malattie da prioni e neurodegenerative.
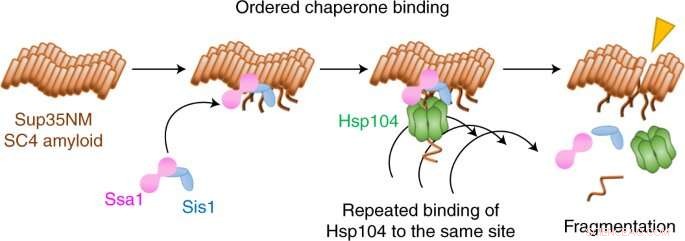
Ora, Yoshiko Nakagawa, Tanaka e colleghi hanno utilizzato una forma di microscopia a fluorescenza a singola molecola per filmare come tre molecole si coordinano per rompere le fibrille amiloidi in un sistema prionico nel lievito.
Hanno scoperto che la rottura inizia con due accompagnatori, Hsp70 e Hsp40, che preparano il terreno legandosi alla fibrilla. Un terzo accompagnatore, Hsp104, quindi scheggia la fibrilla legandosi ripetutamente allo stesso sito.
È interessante notare che il team ha scoperto che oltre a questo meccanismo di frammentazione, un meccanismo di dissoluzione rompe anche le fibrille, ma con una coreografia chaperone molto diversa. Quale meccanismo si verifica dipende dalla forma molecolare, o conferma, della fibrilla.
Ci sono state molte sorprese in questo studio, osserva Tanaka. "Non ci aspettavamo che Hsp104 si attaccasse allo stesso sito così tante volte per frammentare le fibrille amiloidi", afferma. "E le modalità di disaggregazione per le due diverse conferme di fibrille sono molto diverse:il meccanismo di frammentazione ha prodotto molti minuscoli frammenti, mentre la fluorescenza della fibra amiloide è scomparsa gradualmente per il meccanismo di dissoluzione."
Il team intende esplorare i meccanismi in modo più dettagliato e in futuro spera di ottenere una risoluzione atomica. + Esplora ulteriormente