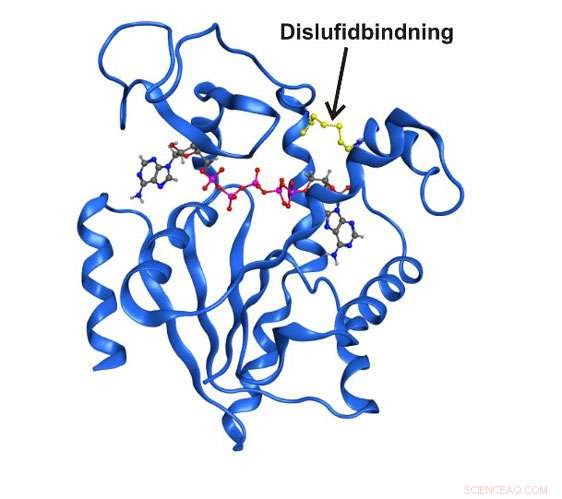
Struttura a raggi X ad alta risoluzione dell'enzima adenilato chinasi intrappolata in uno stato strutturale transitorio da un legame disolfuro covalente. Credito:Università di Umea
I chimici dell'Università di Umeå sono riusciti a mappare le strutture e le funzioni di uno stato enzimatico transitorio. Modificando l'enzima adenilato chinasi, i ricercatori sono stati in grado di isolare la molecola e studiarla utilizzando le tecniche quantitative cristallografia a raggi X e spettroscopia di risonanza magnetica nucleare (NMR). I risultati sono stati pubblicati sulla rivista PNAS .
"Ora abbiamo compiuto un passo avanti verso una comprensione generale di come funzionano gli enzimi. Questo è vitale per i futuri progetti di nuovi enzimi nelle applicazioni biotecnologiche, "dice Magnus Wolf-Watz, professore associato presso il Dipartimento di Chimica dell'Università di Umeå.
La vita biologica dipende da un gran numero di cellule, reazioni chimiche che sono spesso estremamente lente e possono richiedere mesi o anni per essere completate. Affinché i tempi chimici e biologici corrispondano, le reazioni chimiche sono accelerate nelle cellule con l'uso di enzimi come biocatalizzatori efficienti.
Nell'ultimo decennio di ricerca è stato chiarito che le strutture enzimatiche che esistono solo brevemente e transitoriamente possono essere del tutto essenziali per la funzione catalitica. Finora, non è stato possibile studiare in dettaglio questi stati per il semplice fatto che sono invisibili alle tecniche spettroscopiche tradizionali. Ora, i ricercatori del Dipartimento di Chimica dell'Università di Umeå in Svezia sono riusciti a catturare uno stato transitorio centrale per la funzione dell'enzima essenziale adenilato chinasi. Lo stato a breve termine è stato possibile arricchire scambiando due aminoacidi nell'enzima con l'aminoacido reattivo cisteina.
"È la prima volta che qualcuno è riuscito a studiare uno stato enzimatico transitorio direttamente utilizzando tecniche spettroscopiche e quantitative. Con l'uso dei nostri metodi, siamo stati in grado di descrivere in dettaglio sia la struttura che la funzione dell'enzima nella specifica fase transitoria, "dice Magnus Wolf-Watz, che ha condotto lo studio insieme al postdoc Michael Kovermann, che ora detiene una leadership di gruppo presso l'Università di Costanza in Germania.
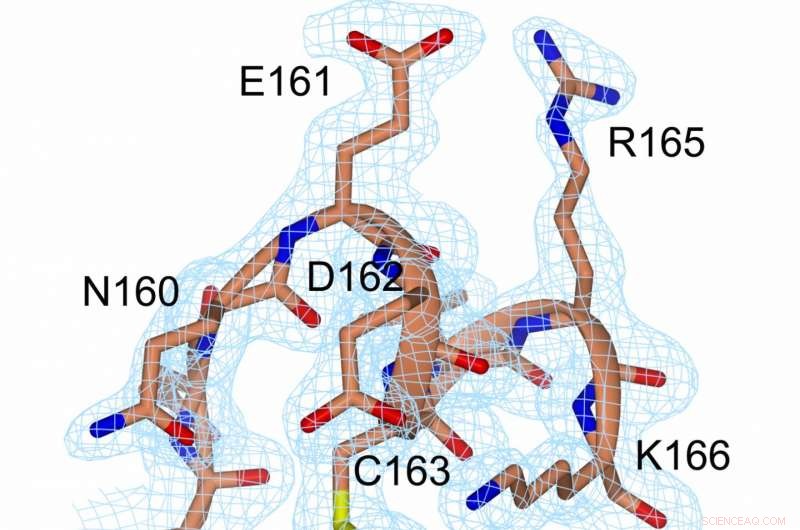
Una rappresentazione della densità elettronica al legame disolfuro (giallo, tra C56 e C163) e nelle sue immediate vicinanze. Credito:Prof. Michael Kovermann, Università di Costanza
I risultati hanno indicato che la funzione in un enzima dipende interamente dalla sua dinamica intrinseca, e senza dinamica l'enzima sarebbe reso inutile. Per di più, si è scoperto che lo stato transitorio ha legato le sue molecole di substrato molto più forte delle proteine naturali. I risultati ci hanno fornito ulteriori indizi su come gli enzimi possono accelerare le reazioni con una specificità ed efficacia così incredibile. Nel frattempo, il metodo che abbiamo sviluppato può essere generalmente utile negli studi di altri enzimi".
Il team NMR di Magnus Wolf Watz ha collaborato allo studio con i cristallografi a raggi X Uwe H. Sauer ed Elisabeth Sauer-Eriksson.
"Abbiamo avuto una collaborazione a lungo termine e molto produttiva. Questo è un buon esempio di quanto sia importante l'atmosfera collaborativa che si trova all'Università di Umeå, e come dovremmo apprezzarlo e svilupparlo ulteriormente in futuro, " dice Magnus Wolf-Watz.