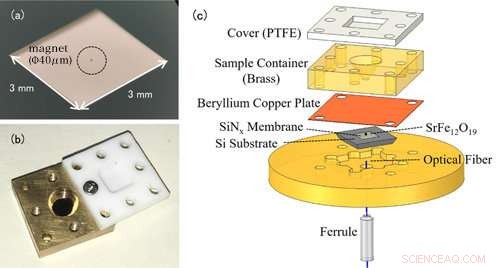
Figura 1:(a) Foto di una nanomembrana. La nanomembrana stessa è molto sottile (100 nm) quindi appare trasparente ad occhio nudo. L'oggetto circondato al centro è un minuscolo magnete per il rilevamento dell'EPR. (b) Foto della cella della soluzione. Il contenitore è ricoperto da un coperchio in teflon per impedire l'evaporazione del campione di soluzione. (c) Il setup sperimentale della spettroscopia EPR rilevata dalla forza. La cella della soluzione contenente il campione di misura è posta sopra la membrana con i magneti attaccati. I cambiamenti nella nanomembrana vengono rilevati dalla fibra ottica al di sotto della membrana. Credito:Università di Kobe
I ricercatori hanno sviluppato un nuovo metodo per analizzare le metalloproteine con solo un minuscolo campione liquido. Questa svolta è stata raggiunta da un gruppo di ricerca guidato dal Professore Associato Eiji Ohmichi e Tsubasa Okamoto presso la Scuola di Scienze della Kobe University. I risultati sono stati pubblicati il 28 novembre in Lettere di fisica applicata .
Le metalloproteine (conosciute anche come proteine leganti i metalli) svolgono ruoli vitali per il trasporto e lo stoccaggio dell'ossigeno, trasporto di elettroni, ossidazione e riduzione. In molti casi, gli ioni metallici in queste proteine sono i centri attivi per queste attività, quindi identificando lo stato esatto di questi ioni, possiamo comprendere i meccanismi alla base delle loro funzioni.
Un metodo sperimentale chiamato risonanza paramagnetica elettronica (EPR) può essere utilizzato per misurare lo stato degli ioni degli elettroni nelle proteine. Le tecniche EPR efficaci richiedono una certa quantità di volume del campione per misurazioni sensibili. Però, molte metalloproteine sono difficili da isolare e raffinare, quindi i ricercatori possono ottenere solo piccoli campioni.
Le misurazioni EPR convenzionali rilevano le onde elettromagnetiche assorbite dagli ioni metallici. La caratteristica notevole di questo studio è l'uso di un dispositivo a forma di trampolino chiamato nanomembrana (figura 1 (a)). In EPR, lo spin dell'elettrone passa a uno stato di alta energia assorbendo onde elettromagnetiche, ma allo stesso tempo, la direzione di rotazione si inverte, e cambiano anche le proprietà magnetiche degli ioni metallici. Prima dell'esperimento, il team di ricerca ha attaccato minuscoli magneti alla nanomembrana, quindi i cambiamenti nella forza di attrazione tra i magneti e gli ioni metallici si trasformano in una forza sulla nanomembrana, e questo segnale EPR viene rilevato. Poiché la nanomembrana è molto sottile, solo 100 nm (=0,1 μm) possiamo misurare sensibilmente piccoli cambiamenti di forza che accompagnano l'assorbimento dell'EPR.
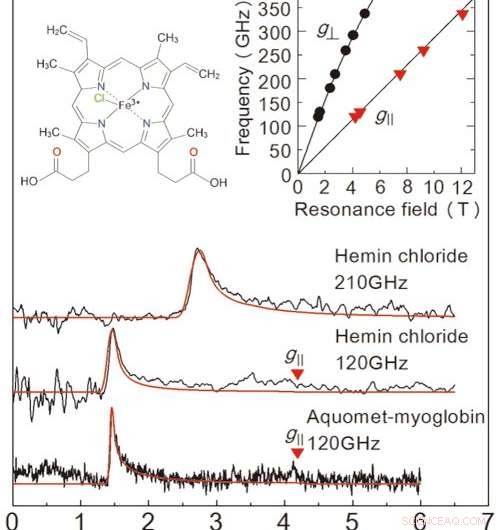
Figura 2:Risultati delle misurazioni EPR ottenute in questo studio da un campione di soluzione congelata. I primi due diagrammi sono per cloruro di emina, e il grafico in basso è per la mioglobina. La linea rossa è un segnale proiettato da un simulatore di valori. Le concentrazioni della soluzione e i volumi del campione erano 50 mM、2 μL per cloruro di emina, e 8,8 mM、10 μL per la mioglobina. Le misurazioni sono avvenute a 4,2 K. Esaminando le due linee nel grafico in alto a destra siamo in grado di determinare l'esatto stato degli ioni ferro. Il grafico in alto a sinistra mostra la struttura molecolare del cloruro di emina. Credito:Università di Kobe
Il campione di soluzione viene posto in una cella di soluzione direttamente sopra la membrana (figura 1 (b)). Il volume delle cellule è di soli 50μL (=0,05 cc), e il team aggiunge circa 1-10μL(0,001-0,01 cc) di soluzione per la misurazione. Per evitare che la soluzione evapori, la cella è coperta da un coperchio in resina. In questo metodo la nanomembrana sottile e fragile è indipendente dalla cella soluzione, facilitando il cambio di campioni (figura 1(c)).
Per valutare le prestazioni di questa configurazione, il team ha effettuato la misurazione EPR su un'alta frequenza (oltre 0,1 THz) per una proteina contenente ferro chiamata mioglobina e il suo complesso modello cloruro di emina (figura 2). Il team è riuscito a rilevare i segnali EPR su un'ampia frequenza d'onda (0,1-0,35 THz) per una concentrazione di 50 mM, 2μL di soluzione di cloruro di emina. Hanno anche osservato un caratteristico segnale EPR per un 8,8 mM, Campione di 10μL di soluzione di mioglobina. Un grande vantaggio di questo metodo è la capacità di misurare su un'ampia gamma di frequenze, rendendolo applicabile per metalloproteine con una varietà di proprietà magnetiche.
Il professor Ohmichi commenta:"Questo nuovo metodo consente di determinare a un livello dettagliato lo stato degli ioni metallici in una piccola quantità di soluzione di metalloproteine. Potremmo essere in grado di applicare il metodo a metalloproteine che in precedenza non potevano essere misurate. Ad esempio , nel nostro metabolismo, una metalloproteina chiamata perossidasi svolge un ruolo cruciale convertendo il perossido di idrogeno in acqua, rendendolo innocuo, ma i dettagli del meccanismo di questo processo reattivo non sono ancora chiari. I risultati di questo studio possono essere potenzialmente applicati come metodo di analisi leader per far luce su questo tipo di fenomeno vitale".