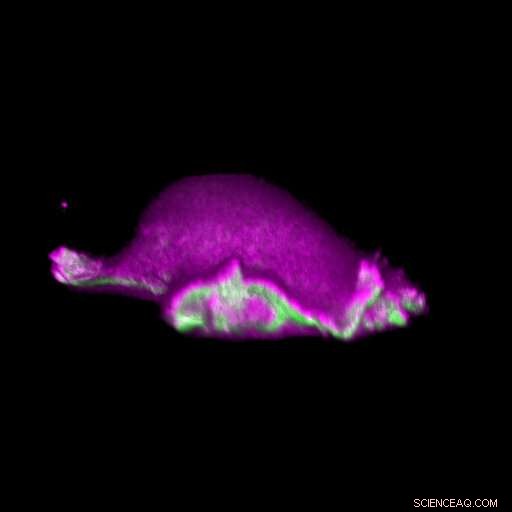
Una cellula si muove in avanti:le proteine I-BAR (rosa) si accumulano nel punto in cui si curva il suo lamellipodium. In tal modo, la cellula può disporre localmente la proteina actina (verde) e generare un ciclo lamellipodiale. Credito:Isabell Begemann, Milos Galic
Quando una singola cella è posta su una superficie piana, non sta fermo, ma inizia a muoversi. Questo fenomeno è stato osservato dal biologo cellulare britannico Michael Abercrombie già nel 1967. Da allora, i ricercatori hanno cercato di capire come le cellule realizzano questa impresa. Questo è noto:le cellule formano i cosiddetti lamellipodi - sporgenze cellulari che crescono e si contraggono continuamente - per spingersi verso segnali di segnalazione come attrattivi chimici prodotti e secreti da altre cellule. Quando mancano tali segnali esterni, come nell'osservazione di Abercrombie, le cellule iniziano a cercarli attivamente. Così facendo, usano modelli di ricerca che possono essere osservati anche negli squali, api o cani. Si muovono transitoriamente in una direzione, fermare, muoviti sul posto per un po', e poi continuare a muoversi in un'altra direzione. Ma come fanno le cellule a mantenere la direzione del loro movimento per un periodo di tempo più lungo?
I ricercatori del Cluster di eccellenza Cells-in-Motion dell'Università di Münster (Germania) ora riportano una risposta a questa domanda. Hanno scoperto che la geometria della membrana può innescare successivi cicli lamellipodiali:le forze meccaniche causano la generazione della curvatura della membrana dove si aggregano alcune proteine che riconoscono questa geometria. Queste proteine, a sua volta, permettere alla cellula di formare i lamellipodi. "La curvatura, generato durante la retrazione predetermina la crescita del successivo ciclo lamellipodiale. È così che il meccanismo si riattiva costantemente, " spiega il biologo Dr. Milos Galic, capogruppo di ricerca junior presso il Cluster of Excellence, e autore senior dello studio. Quando mancano i segnali esterni, una cellula non si limita a fermarsi e scandire il tempo, ma si dirige momentaneamente in una direzione e pattuglia in modo efficiente il suo ambiente. Lo studio è stato pubblicato su Fisica della natura rivista.
Il punto di partenza dello studio è stata una sorprendente osservazione fatta durante l'analisi di immagini microscopiche. I ricercatori stavano studiando come le cellule formassero i lamellipodi e, conseguentemente, come sono cambiati il movimento e la forma delle cellule. Hanno scoperto che i lamellipodi si sono evoluti in un'ampia gamma di dimensioni e hanno avuto durate di vita molto diverse.
"Nei dati, non siamo riusciti a riconoscere alcun modello ricorrente nella crescita e nella contrazione dei lamellipodi, " dice l'autore principale Dr. Isabell Begemann, un biologo che ha svolto lo studio come parte della sua tesi di dottorato. I ricercatori sono stati in grado di determinare che i siti di successiva estensione dei lamellipodi si sono verificati ovunque la membrana cellulare abbia sviluppato una forte curvatura. Hanno quindi ipotizzato che un meccanismo legato a queste curvature possa determinare cicli di moto continui e, conseguentemente, persistenza del movimento.
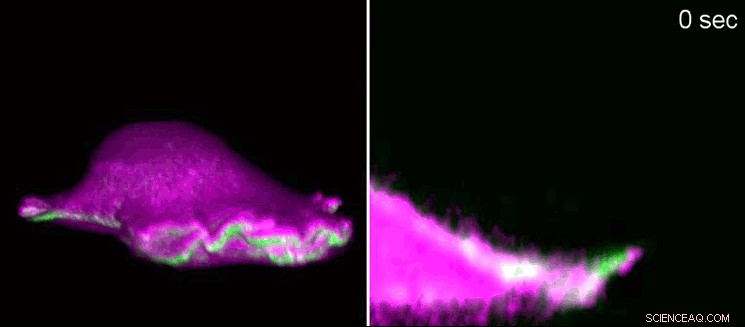
Un fibroblasto di topo avanza utilizzando un “lamellipodium”. Sulla sinistra, vista laterale in 3D, sulla destra, una sezione che ingrandisce il lamellipodio. Le proteine I-BAR (rosa) si accumulano all'inizio del lamellipodium a causa della curvatura della membrana cellulare. Come conseguenza, la cellula può disporre localmente la proteina actina (verde) e il lamellipodium ricresce. Utilizzando la microscopia a fluorescenza a foglio di luce reticolare, i ricercatori hanno mostrato le minuscole strutture in 3D. I lamellipodi hanno un'altezza da 100 a 200 nanometri. Credito:Isabell Begemann, Milos Galic
Biologi, biochimici e fisici hanno lavorato a stretto contatto per indagare su questa idea. Hanno prima sviluppato biosensori per etichettare i siti altamente curvi sulla membrana cellulare, e li ha visualizzati con vari mezzi di microscopia ad alta risoluzione. A tal fine, hanno collegato molecole fluorescenti con i cosiddetti domini I-BAR. Queste sono regioni di proteine a forma di banana il cui lato caricato positivamente si lega alla membrana cellulare caricata negativamente, ma solo quando la membrana è curva.
Sfruttando questi biosensori, i ricercatori sono stati in grado di dimostrare che le proteine sensibili alla curvatura si accumulano nei siti in cui si contrae il lamellipodium. Una volta arricchito, queste proteine inducono forze sporgenti nella cellula attraverso la proteina actina, che innesca la crescita del lamellipodium. In un passaggio successivo, i ricercatori hanno sviluppato un modello matematico che ricostituisce il meccanismo e lo hanno simulato al computer utilizzando varie combinazioni di parametri. Il confronto delle previsioni derivate dal modello matematico con i dati di imaging sperimentali complementari ha ulteriormente rafforzato i risultati trovati finora.
I ricercatori hanno trovato prove della presenza del meccanismo di motilità identificato nei modelli di coltura cellulare, Per esempio, nelle cellule del tessuto connettivo derivate da topi, nelle cellule dei vasi sanguigni umani dal cordone ombelicale, e anche nelle cellule immunitarie umane, ad es. un tipo di cellula che infatti si muove liberamente all'interno dell'organismo. Finalmente, i ricercatori volevano anche sapere quali effetti aveva il meccanismo proposto sul modello di motilità di una cellula.
"Abbiamo down-regolato le proteine I-BAR, permettendoci di entrare nel sistema di auto-organizzazione della cellula, " dice Milos Galic. Senza il meccanismo, la cellula riesce ancora a muoversi, ma l'area di ricerca diventa sostanzialmente più piccola. Parallelamente a questo meccanismo, ci sono altri macchinari che si intrecciano, ma il meccanismo ha un'influenza sul modello di motilità di una cellula. I risultati dello studio potrebbero, nel futuro, aiutano a rispondere a domande fondamentali sui processi negli organismi che coinvolgono cellule in movimento libero.