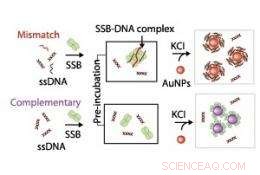
Illustrazione schematica che mostra il meccanismo utilizzato per sondare le interazioni tra DNA a filamento singolo (ssDNA) e proteina legante il DNA a filamento singolo (SSB). Credito:2011 ACS
Il DNA a doppio filamento deve districarsi in filamenti singoli durante la replicazione o la riparazione per consentire alle molecole funzionali di legarsi ed eseguire le loro varie operazioni. Le proteine cellulari si legano specificamente al DNA a singolo filamento per prevenire la loro ricombinazione prematura. Sfortunatamente, studi dettagliati di queste interazioni DNA-proteina sono stati ostacolati dalla necessità di strumentazione costosa e tecniche di etichettatura che richiedono tempo. Yen Nee Tan dell'A*STAR Institute of Materials Research and Engineering e collaboratori1 hanno ora sviluppato un metodo conveniente per caratterizzare le interazioni tra il DNA a singolo filamento e le loro proteine leganti.
I ricercatori hanno utilizzato le proprietà ottiche delle nanoparticelle d'oro per sondare il meccanismo del legame proteina-DNA. Quando le nanoparticelle sono state ben disperse in soluzione, hanno dato un colore rosso vivo, ma quando aggregato, la soluzione è cambiata in blu. Tan e colleghi hanno scoperto che quando il DNA a filamento singolo e la sua proteina legante erano entrambi presenti nella soluzione, accoppiato con un sale che stimola l'aggregazione delle nanoparticelle, il DNA è rimasto di colore rosso, indicando che i complessi DNA-proteina si erano legati alle nanoparticelle attraverso forze di stabilizzazione elettrosteriche. In contrasto, quando la proteina o il DNA a singolo filamento è stato introdotto da solo nella soluzione salina, c'è stato un maggiore spostamento verso il colore blu-grigio, che indica l'aggregazione di nanoparticelle (vedi immagine).
“La sfida più grande in questo lavoro è stata quella di determinare le condizioni ottimali per il legame del DNA a singolo filamento con la sua proteina legante per formare complessi che conferiscono la massima stabilità alle nanoparticelle d'oro dall'aggregazione indotta dal sale, "dice Tan.
I ricercatori attribuiscono il legame delle nanoparticelle e dei complessi DNA-proteina alla presenza di gruppi contenenti zolfo nella proteina, che sono noti per creare forti legami con l'oro. Le molecole proteiche da sole sono di dimensioni molecolari inferiori rispetto ai complessi proteina-DNA, portando ad una stabilizzazione sterica meno efficace delle nanoparticelle.
Tan e colleghi hanno mostrato che esisteva una lunghezza minima della sequenza di DNA sotto la quale il meccanismo di adesione proteina-DNA poteva operare. Hanno scoperto che la proteina legante ha una preferenza per il legame a specifiche unità chimiche (basi) che compongono il DNA, e sono stati in grado di individuare variazioni di sequenza del DNA, chiamati polimorfismi a singolo nucleotide (SNP), anche alle estremità della molecola che sono difficili da identificare. Il DNA a doppio filamento con gli SNP non può legarsi così strettamente. La proteina legante può quindi legarsi al DNA a singolo filamento dissociato per formare complessi proteina-DNA, offrendo siti a cui le nanoparticelle d'oro possono aderire.
“Abbiamo in programma di sviluppare ulteriormente questo test in un test di genotipizzazione senza problemi per rilevare gli SNP in campioni biologici reali contenenti DNA genomico lungo, "dice Tan.