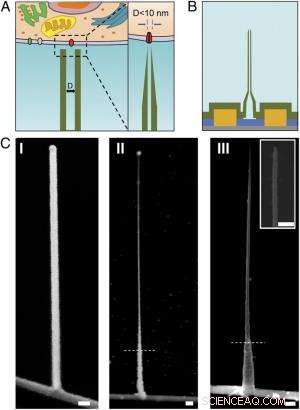
Schemi e immagini SEM del BIT-FET ultrapiccolo. ( UN ) Illustrazione schematica di una sonda bioelettronica intracellulare. ( Sinistra ) Schema generale di una sonda per la registrazione elettrofisiologica intracellulare. ( Destra ) Una vista ingrandita della punta di una sonda bioelettronica sub-10-nm e la sua dimensione relativa al singolo canale ionico. ( B ) Struttura schematica del BIT-FET ultrapiccolo. Verde, giallo, blu, e i colori grigi rappresentano SiO 2 strato, contatto metallico, SiNW, e substrato di nitruro di silicio, rispettivamente. ( C ) Immagini SEM del BITFET ultrapiccolo in diverse fasi di fabbricazione. Un ramo GeNW è stato inizialmente coltivato sopra SiNW ( io ), seguito da un successivo H 2 oh 2 attacco della parte superiore di GeNW per ridurne il diametro fino a un regime inferiore a 10 nm ( II ). Una vista finale di un BIT-FET ultrapiccolo con ID di nanotubi ∼8 nm, e SiO 2 lo spessore della parete ∼10 nm è presentato in ( III ). inserto di III è il primo piano della punta dell'ultrapiccolo SiO 2 nanotubo. Linee tratteggiate bianche in II e III indicare il punto al di sotto del quale GeNW e SiO 2 è protetto da fotoresist durante H 2 oh 2 e incisione BHF, rispettivamente. Tutte le barre della scala:100 nm. Credito:Copyright © PNAS, doi:10.1073/pnas.1323389111
(Phys.org) — Le sonde bioelettroniche miniaturizzate sono in grado di trasformare la biologia e la medicina consentendo la misurazione dei componenti intracellulari in vivo . Recentemente, scienziati dell'Università di Harvard e dell'Università di Pechino hanno progettato, ha fabbricato e dimostrato sonde bioelettroniche di appena 5 nanometri utilizzando un'esclusiva eterostruttura tridimensionale di nanofili e nanotubi. (Un'eterostruttura combina più eterogiunzioni – interfacce tra due strati o regioni di semiconduttori cristallini dissimili – in un unico dispositivo.) Attraverso misurazioni sperimentali e simulazioni numeriche, i ricercatori hanno dimostrato che questi dispositivi hanno una risoluzione temporale sufficiente per registrare i segnali elettrici più veloci nei neuroni e in altre cellule, con l'integrazione in array di chip più grandi che forniscono potenzialmente una mappatura ad altissima risoluzione dell'attività nelle reti neurali e in altri sistemi biocellulari.
La prof.ssa Xiaojie Duan ha discusso il documento che lei, Ricercatore laureato Tian-Ming Fu, Il Prof. Charles M. Lieber e i loro coautori pubblicati in Atti dell'Accademia Nazionale delle Scienze . Innanzitutto sottolinea che le sonde a nanotubi e la loro eterogiunzione con i transistor a effetto di campo a nanofili di silicio (SiNW FET) diventano meccanicamente meno stabili man mano che il diametro si riduce. "Quando il nanotubo diventa sempre più piccolo, " Duan dice a Phys.org, "diventa più facile rompere il nanotubo nell'area di giunzione con il SiNW. Nell'applicazione dell'utilizzo della sonda per il rilevamento bioelettronico intracellulare, ci saranno varie forze, come la forza capillare del liquido, così come l'interazione tra la sonda e la membrana cellulare. Queste forze possono rompere la sonda se abbiamo una giunzione debole tra essa e il SiNW".
Un altro problema è che anche la sensibilità elettrica si riduce al diminuire del diametro dei nanotubi, perché il diametro interno del nanotubo (ID) definisce l'effettiva area di gate del dispositivo. "Nella registrazione del potenziale transmembrana intracellulare utilizzando la nostra sonda, "Duan spiega, "il citosol riempie il nanotubo e funge da elettrodo di gate per il SiNW FET sottostante". citosol (chiamato anche liquido intracellulare o matrice citoplasmatica ) è il liquido che si trova all'interno delle cellule, esclusi organelli e altri componenti citoplasmatici. "Il cambiamento del potenziale del citosol modula la densità dei portatori del SiNW FET, cambiando così la sua conduttanza, " Continua Duan. "Così funziona la nostra sonda per la registrazione bioelettronica." L'area di contatto tra il citosol e il SiNW - definita dal diametro interno del nanotubo - determina l'efficacia della modulazione della conduttanza. In altre parole, se il diametro interno del nanotubo è troppo piccolo, anche l'area del gate SiNW FET sarà troppo piccola.
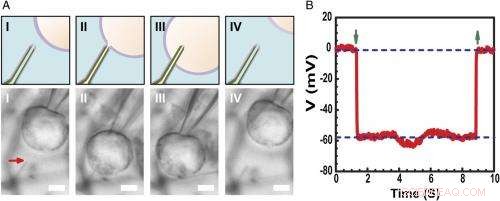
Registrazione del potenziale di membrana a riposo intracellulare. ( UN ) Schemi (superiore) e immagini al microscopio ottico a contrasto di interferenza differenziale ( Inferiore ) di una cellula HL-1 manipolata da una micropipetta di vetro per avvicinarsi ( io ), contatto ( II ), penetrare ( III ), e ritirare ( IV ) da una sonda BITFET ultrapiccola modificata con fosfolipidi. La freccia rossa indica la posizione della punta del nanotubo ultrapiccolo. Perché puro SiO 2 il nanotubo è otticamente trasparente, il modello GeNW di questo dispositivo non è stato inciso per l'imaging. Barra della scala:2 μm. ( B ) Risultati di registrazione elettrica rappresentativi da un dispositivo BIT-FET ultrapiccolo ID ∼10 nm; in questo caso, il GeNW è stato inciso per produrre l'ultrapiccolo SiO 2 nanotubo. Le frecce verdi rivolte verso il basso e verso l'alto segnano l'inizio della penetrazione e del ritiro delle cellule, rispettivamente. Le linee tratteggiate orizzontali superiore e inferiore indicano i potenziali extracellulari e intracellulari. Le misurazioni water-gate quasi statiche effettuate prima/dopo le misurazioni delle celle mostrano una variazione <2% della conduttanza e della sensibilità del dispositivo. Credito:Copyright © PNAS, doi:10.1073/pnas.1323389111
Ai ricercatori è stato anche presentato il fatto che la risposta dinamica ad alta frequenza può degradarsi con la diminuzione del diametro interno del nanotubo a causa dell'aumento della resistenza alla soluzione nel nanotubo. "Quando il diametro interno del nanotubo diminuisce, "Duan spiega, "aumenterà la resistenza della soluzione all'interno del nanotubo, a causa della diminuzione della sezione del conduttore della soluzione." Inoltre, la velocità con cui il FET SiNW sottostante può rispondere a un segnale è determinata dal prodotto RC della capacità e della resistenza del conduttore di soluzione all'interno del nanotubo, quindi se il nanotubo si sta riducendo, la resistenza è sempre più grande. Ciò significa che il SiNW FET avrà bisogno di più tempo per rispondere - e se il cambio di segnale è troppo veloce, la sonda non sarà in grado di registrarlo in modo affidabile. "Questo è ciò che intendiamo per 'la risposta dinamica ad alta frequenza si degraderà con la diminuzione del diametro interno dei nanotubi, ' Duan aggiunge, "Però, abbiamo scoperto che per la nostra sonda, anche se riduciamo il diametro interno del nanotubo fino a 5 nm, la sonda è ancora in grado di registrare fedelmente un segnale a 3 kHz, una larghezza di banda sufficiente nella maggior parte dei casi per la registrazione di segnali neurali e cardiaci."
I ricercatori si sono trovati anche di fronte alla necessità di utilizzare rivelatori di transistor ad effetto di campo a nanocavi a semiconduttore attivo per superare i limiti della riduzione delle dimensioni della sonda. "La parola attivo" è paragonata alla natura "passiva" della registrazione con elettrodi metallici, " sottolinea Duan. "Per la registrazione con elettrodi metallici, una parte del potenziale transmembrana V m will be dropped or lost at the electrode/electrolyte interface, so the signal recorded will be smaller than the real transmembrane potential." When the size of the metal electrode is reduced, the impedance value at the electrode/electrolyte will increase – and at some point, this impedance will get so large that the recorded signal will be obscured by noise. Però, for the FET recording, the cytosol potential change is reflected by the semiconductor channel conductance change, which is independent of the probe/electrolyte interface impedance. "Since decrease in probe size will therefore non affect the signal amplitude, " Duan adds, "using the FET to sense potential is a very effective way to overcome the limitations of probe-size reduction."
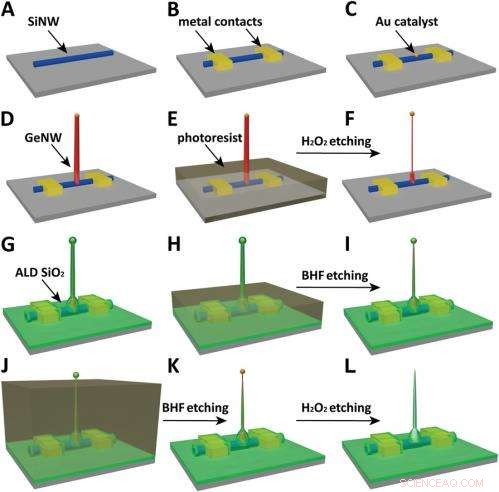
Schematics of the fabrication flow for the ultrasmall BIT-FET. ( UN ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( D ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H 2 oh 2 -etched GeNWs following photoresist liftoff. Only the GeNW above the photoresist in E is thinned by etching in H 2 oh 2 . (G) SiO 2 is conformally deposited over the entire chip by ALD. ( h ) A thin layer of photoresist (transparent gray) is spin coated to protect the lower region of chip. ( io ) The resulting BHF etched structures following liftoff. The region of SiO 2 above the photoresist layer in h is etched to ca.10-nm thickness. ( J ) Photoresist with thickness smaller than the GeNW heights is deposited. ( K ) The resulting structure following BHF etching of SiO2, which exposes the tips of the GeNWs. Isotopic BHF etching yields a small taper with thinner SiO 2 at the topmost part of the structure. (L) The GeNW is removed by H 2 oh 2 etching to form an ultrasmall nanotube connected to the bottom SiNW FET. Copyright © PNAS, doi:10.1073/pnas.1323389111
Another critical challenge was synthetically integrating nanotubes and nanowires. "The nanotube is made of silicon oxide and the nanowire is made of silicon, " Du an notes. "For cell recording, the nanotube needs to be built vertically onto the nanowires – meaning that a three-dimensional heterostructure is needed." While the heterostructure could be fabricated in various ways, not all of them provided the required controllability at the probe scale. Perciò, the researchers grew a germanium nanowire (GeNW) on top of the silicon nanowires, with the GeNW acting as a template for the nanotube. "Depositing SiO 2 on the GeNW/SiNW heterostructure, then selectively removing the core GeNW, resulted in the desired nanotube/SiNW structure, " notes Duan. "Using this method, the nanotube inner diameter can be controlled by the GeNW diameter, the outer diameter can be controlled by the SiO 2 thickness, and the nanotube length can be defined by the GeNW growth time. This gives us complete and easily implemented control over the probe's dimensions."
Finalmente, the scientists had to investigate and model the bandwidth effect of phospholipid coatings, which are important for intracellular recording. "We use phospholipid coating to assist the nanotube probe to penetrate the cell membrane, " Duan notes. "Since the bandwidth of our probe is important for the probe to be able to record fast neural or cardiac signal, we need to make sure this phospholipid modification will not overly affect the bandwidth." Because the phospholipid layer will decrease the cross section of the solution conductor inside the nanotube, it impacts bandwidth in two ways by changing the capacitance and resistance of the solution inside the nanotube. (The phospholipid-modified probe bandwidth is easily determined by applying a fast artificial signal to the solution, and then recording how the conductance of the device changes over time. This provides the time the device needs to respond to this signal and thus the device's bandwidth.) "Therefore, " Duan explains, "if the nanotube is large, this thin phospholipid layer will not cause too much of a difference. Però, for our probe, the sub-10 nm nanotube size is almost the same scale as the lipid layer – so we have to carefully examine how it affects probe bandwidth, both experimentally and theoretically."
The scientists addressed these myriad challenges in designing, fabbricare, and demonstrating the probe with three key innovations. "The first is the use of FET as potential sensing element, which in principle enables us to overcome the size limit on the probe." Duan explains. "However, FETs have conventionally existed in a linear geometry with connections that preclude access to the inside of cells." The second innovation was the solution to this problem – namely, the design of a vertical SiO 2 nanotube on top of the nanoscale FET, which allowed them to introduce cytosol into the cell without having to insert the FET channel inside the cell, which would be more invasive. The third key is the design of a relatively large nanotube base with a much sharper nanotube tip, resulting in a sub-10 nm probe without sacrificing its mechanical strength and electrical sensitivity.
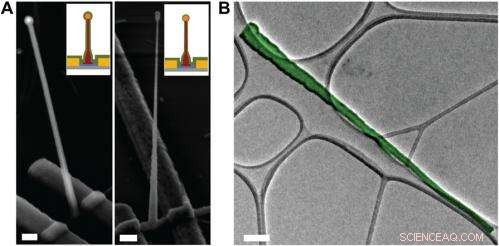
Electron microscopy characterization of the ultrasmall BIT-FET. ( UN ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( Left ) Device after 30-nm ALD coating of SiO 2 . ( Destra ) Device after first step of selective BHF etching of the upper80% portion of the SiO 2 to ca. 10 nm (Fig. S1 h e io ). White dashed lines in io e II indicate the point below which the SiO 2 is protected by photoresist during BHF etching. Scale bars:200 nm. ( B ) False-colored transmission electron microscopy (JEOL 2100 TEM) image of an ultrasmall nanotube. This tube was fabricated following the same procedure as described in SI Text , and deposited onto lacey carbon grids (Ted Pella) from ethanol suspension. It has a tip ID ∼7 nm and bottom ID ∼80 nm. False color is used here to distinguish the SiO 2 nanotube from background amorphous carbon. Scale bar:50 nm. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
An important aspect of the study was ensuring that the bioelectronic devices had sufficient time resolution to record the fastest electrical signals in neurons and other cells. "The signals in neural system are normally in the millisecond scale, " Duan points out. "That means that to reliably record these signals, the recording device needs to have a bandwidth measure in kilohertz." While the probe's bandwidth decreases with the decrease of nanotube diameter, the scientists found that even for probes with inner diameters as small as 5 nm, the bandwidth is still around 3 kHz (a time resolution ~ 0.3 ms) in physiological solution. "This means that our probes have sufficient time resolution to record the fastest electrical signals in neurons and other cells, " Duan adds.
Inoltre, Duan points out, the scientists found that measuring the cell transmembrane resting potential with these ultrasmall bioelectronic devices demonstrates the capability for intracellular electrophysiology studies. "When we measured the transmembrane resting potential of HL-1 cell with our new probes, we found that with the phospholipid modification, the nanotube can easily and reliably penetrate the cell membrane, allowing the FET to record the intracellular transmembrane potential at full amplitude." After retracting the nanotube from the cell, the recorded potential can immediately revert to the extracellular potential. "Reliable cell membrane penetration and stable recording of intracellular transmembrane potential prove the capability of our probes for intracellular electrophysiology studies, " notes Duan.
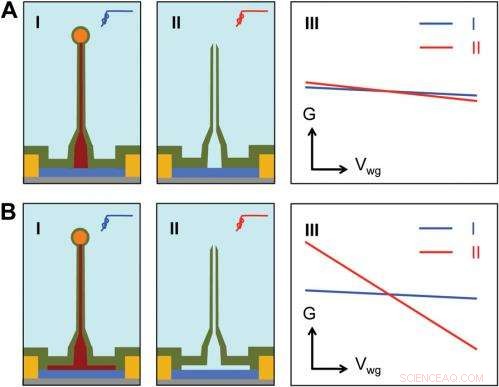
Sensitivity of different device structures. ( UN , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, rispettivamente. io e II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( G ) vs. water-gate (V wg ) measurements from these distinct structures. Credit:Copyright © PNAS, doi:10.1073/pnas.1323389111
Andando avanti, says Duan, the researchers' are planning to scale up their work to integrate the probes into high-density, large-scale array for large-scale mapping of neural activities; use the probes to record neural signals from small subcellular structures/organelles; and investigate other applications in which the probes will provide substantially greater spatial resolution and minimal invasiveness than other techniques.
Inoltre, the scientists might consider developing other innovations. "Per esempio, " Duan illustrates, "a major challenge in using our ultra-small probes for recording from small subcellular structures is to accurately position them with respect to the subcellular structures of interest. We're looking at either labeling our probe with fluorescence dye – or other biocompatible materials – to mark the nanotube at high resolution, or using specific targeting in which the probe's biochemical surface groups define the specific cell location being studied."
Duan sees other areas of research that might benefit from their study, including:
© 2014 Phys.org. Tutti i diritti riservati.