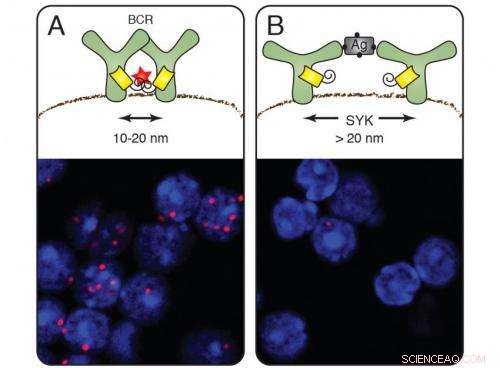
Sulle cellule a riposo (A) i recettori dell'antigene delle cellule B formano gruppi e il nano righello emette segnali rossi (colorazione delle cellule sotto). Dopo l'attivazione delle cellule B da parte di un antigene, il segnale rosso scompare (B). La chinasi Syk media l'apertura del recettore. Credito:Michael Reth
Dopo dieci anni di sforzi, Il Prof. Dr. Michael Reth dell'Istituto di Biologia III dell'Università di Friburgo e dell'Istituto Max Planck di Immunobiologia ed Epigenetica ha sviluppato un metodo per studiare l'organizzazione della superficie cellulare su scala nanometrica. Questo gli permette di monitorare come il recettore dell'antigene, che le cellule B del sistema immunitario utilizzano per riconoscere le sostanze estranee, modifiche dopo l'attivazione. Questo studio mostra che i componenti del recettore si dissociano l'uno dall'altro, piuttosto che assemblarsi, come precedentemente ipotizzato. La riorganizzazione dei recettori sulla membrana cellulare avviene in un intervallo da 10 a 40 nanometri. Al microscopio ottico, però, è possibile distinguere solo oggetti che si trovano ad almeno 250 nanometri di distanza.
Utilizzando frammenti di anticorpi, i cosiddetti Fab, Reto, relatore del cluster di eccellenza BIOSS Center for Biological Signaling Studies dell'Università di Friburgo, e il suo team ha migliorato la risoluzione del test di legatura di prossimità (PLA) precedentemente sviluppato circa 10 volte.
Questa tecnologia consente il rilevamento di molecole solo quando si trovano in stretta vicinanza l'una all'altra. Con l'aiuto del metodo Fab-PLA più preciso, gli scienziati sono stati in grado per la prima volta di studiare su una scala di dieci nanometri come i recettori sono distribuiti sulla membrana e come vengono riorganizzati. Il metodo Fab-PLA è un nuovo importante strumento per il BIOSS Nanoscale Explorer Programme (BiNEP), uno dei centri di ricerca presso il Cluster of Excellence BIOSS Center for Biological Signaling Studies dell'Università di Friburgo.
Quando applicato ai recettori dell'antigene, il metodo Fab-PLA ha rivelato punti fluorescenti rossi sulla membrana cellulare delle cellule B inattive:prova che i recettori dell'antigene compaiono per la prima volta sulla membrana in gruppi, cosiddetti cluster di recettori. Non appena le cellule B hanno rilevato un antigene e sono state attivate, però, i punti sono scomparsi:i recettori si sono allontanati l'uno dall'altro. Questa scoperta supporta il modello di dissociazione dell'attivazione delle cellule B proposto da Michael Reth e Jianying Yang nel 2010.
I ricercatori hanno anche dimostrato come avviene la dissociazione:hanno cancellato nelle cellule B il gene che codifica per la molecola di segnalazione Syk, una chinasi che coopera strettamente con il recettore dell'antigene. Su cellule B senza Syk i cluster di recettori erano ancora presenti dopo che avevano legato l'antigene. Syk è quindi la chiave molecolare che apre il cluster di recettori e avvia la risposta immunitaria. Al fine di chiarire ulteriori dettagli sull'attivazione delle cellule B, i ricercatori hanno introdotto Syk ei componenti del recettore dell'antigene nelle cellule del moscerino della frutta. Hanno modificato Syk e hanno determinato che il cluster non si rompe finché la molecola non si lega alla parte interna del recettore dell'antigene.
I ricercatori hanno pubblicato i loro risultati nella nuova rivista ad accesso aperto eLife . Lo studio includeva anche un'indagine sull'organizzazione su scala nanometrica di ulteriori recettori sulle cellule B, compresa la molecola CD19 o CD20. "Abbiamo scoperto che molti recettori sono organizzati sulla membrana in aree specifiche a livello di nanoscala, " spiega Kathrin Kläsener, Studente di dottorato e autore principale dello studio. La ricerca è stata finanziata in parte da un Advanced Grant per l'analisi su nanoscala delle isole proteiche sui linfociti del Consiglio europeo della ricerca (ERC), che Reth ha ricevuto nel 2012.