I filamenti raggruppati sono stati prodotti dai cristalli tramite una risposta allo stress ossidativo dei tioli cisteinici dopo l'isolamento dei cristalli dalle cellule viventi. Questo metodo sarà considerato un utile progresso nella scienza dei materiali nano-bio e nella chimica supramolecolare come metodo di sintesi per la costruzione di assemblaggi sostenibili utilizzando cristalli proteici. Credito:Tokyo Tech
Le proteine sono senza dubbio alcune delle biomolecole più affascinanti, e svolgono molte delle funzioni che (ai nostri occhi) separano la vita dalla materia inanimata. Gli assemblaggi proteici multimolecolari hanno anche funzioni strutturali su larga scala, come testimoniano le piume, capelli, e squame negli animali. Non dovrebbe sorprendere che, con i progressi nelle nanotecnologie avanzate e nella bioingegneria, gli assemblaggi proteici artificiali hanno trovato applicazioni in una varietà di campi, compresa la catalisi, stoccaggio molecolare, e sistemi di somministrazione dei farmaci.
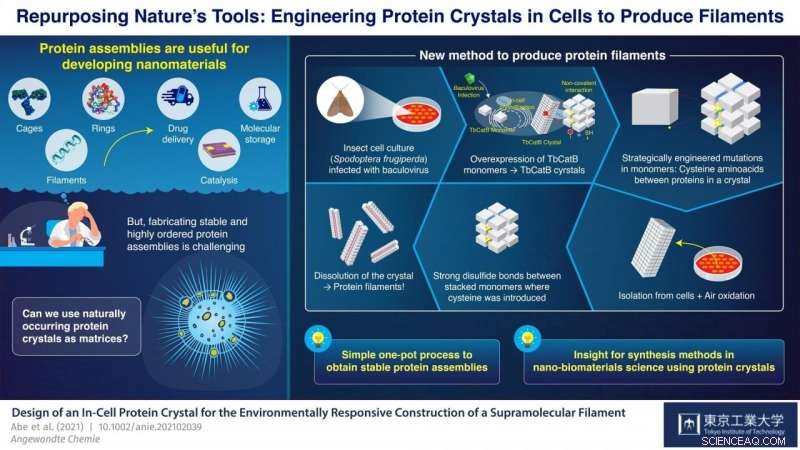
Però, produrre assemblaggi proteici ordinati rimane impegnativo. È particolarmente difficile ottenere monomeri, gli elementi costitutivi delle proteine, assemblare stabilmente nelle strutture desiderate; ciò richiede generalmente una progettazione e un controllo molto accurati delle condizioni di sintesi, come il pH (acidità) e la temperatura. Studi recenti hanno trovato modi per aggirare questo problema utilizzando cristalli di proteine, disposizioni molecolari solide che si trovano naturalmente in alcuni organismi, come matrici precursori per produrre assemblaggi proteici.
Al Tokyo Institute of Technology, Giappone, un team di scienziati guidato dal professor Takafumi Ueno ha lavorato a un approccio promettente per sintetizzare gruppi proteici da cristalli proteici. La loro strategia prevede l'introduzione di mutazioni nel codice genetico di un organismo che produce naturalmente cristalli di proteine. Queste mutazioni causano la formazione di legami disolfuro (S-S) tra i monomeri in posizioni molto specifiche nei cristalli. I cristalli vengono quindi sciolti, ma invece di scomporre completamente nei loro singoli monomeri come al solito, i legami S-S di nuova introduzione tengono insieme gruppi di monomeri e i cristalli si dividono in molti degli assemblaggi proteici desiderati. Con questo approccio, Il team di Ueno è riuscito a sintetizzare gabbie e tubi proteici essenzialmente utilizzando cellule viventi come stampanti nano-3D.
Nel loro ultimo studio, che è stato pubblicato in Angewandte Chemie Edizione Internazionale , il team ha dimostrato un'altra applicazione della loro nuova strategia; questa volta per la sintesi di filamenti proteici in bundle. Hanno usato una coltura di cellule di insetto (Spodoptera frugiperda) infettate da un virus che ha causato la sovraespressione di un monomero chiamato "TbCatB". Questi monomeri si aggregano naturalmente all'interno delle cellule in cristalli proteici, che sono tenuti insieme dalle interazioni non covalenti relativamente deboli tra i monomeri. Gli scienziati hanno introdotto strategicamente due mutazioni nelle cellule in modo che ogni monomero avesse due gruppi tiolici (-SH) della cisteina nei punti critici di interfaccia con altri monomeri.
I cristalli sono stati estratti dalle cellule e lasciati ossidare a temperatura ambiente, che ha causato la trasformazione dei gruppi tiolici in forti legami S-S tra monomeri adiacenti lungo un'unica direzione per autossidazione sotto aria. Quando i cristalli furono dissolti, questi legami disolfuro, insieme ad alcune persistenti interazioni non covalenti, ha portato alla formazione di filamenti proteici in bundle larghi due monomeri, circa 8,3 nanometri. "Con la nostra strategia, abbiamo ottenuto una disposizione estremamente precisa delle molecole proteiche sopprimendo l'aggregazione casuale di monomeri a causa di legami di solfuro indesiderati, il tutto in un processo one-pot relativamente semplice, " evidenzia Ueno.
Globale, l'approccio dimostrato dal team di Tokyo Tech rappresenta un modo innovativo per sintetizzare le strutture proteiche tramite l'ingegneria genetica razionale e utilizzando gli strumenti naturalmente disponibili per le cellule di determinati organismi. "Consideriamo il nostro metodo di sintesi un utile progresso nella scienza dei nano-biomateriali e nella chimica supramolecolare per la produzione di assemblaggi stabili desiderati da cristalli di proteine, " conclude Ueno. Solo il tempo dirà quali altre strutture molecolari utili possono essere prodotte utilizzando questa strategia e quali interessanti applicazioni troveranno.