Il fattore limitante nella radioterapia del cancro è che dosi sufficientemente elevate da cercare di curare i tumori danneggiano anche i tessuti normali circostanti. Credito:Shutterstock
Il cancro è la seconda causa di morte a livello globale. Nel 2018, ci sono stati 18,1 milioni di nuovi casi e 9,5 milioni di decessi correlati al cancro in tutto il mondo. Entro il 2040, il numero di nuovi casi di cancro all'anno dovrebbe salire a 29,5 milioni e il numero di decessi correlati al cancro a 16,4 milioni.
Circa il 50 percento di tutti i malati di cancro può trarre beneficio dalla radioterapia nella gestione della propria malattia. Circa la metà di questi pazienti viene diagnosticata abbastanza presto da poter curare il loro cancro. Per molti tumori, compreso quello al seno, prostata, cervice, testa e collo, tumori polmonari e cerebrali, il trattamento curativo include la radioterapia. Però, perché la radioterapia distrugge sia le cellule sane che le cellule tumorali, le dosi sono limitate.
Radioterapia, chiamata anche radioterapia, è usato da solo per curare il cancro o con altre opzioni di trattamento come la chemioterapia e la chirurgia. Può anche essere usato per ridurre il tumore prima dell'intervento chirurgico. Nella radioterapia, le cellule tumorali, che si dividono molto più velocemente delle altre cellule sane circostanti, vengono distrutte danneggiando il loro DNA.
Gli effetti collaterali limitano la dose di radiazioni
Il fattore limitante nella radioterapia è che dosi sufficientemente elevate da cercare di curare i tumori non metastatici ad alto rischio (localmente avanzati) danneggiano anche i tessuti normali circostanti. Attualmente, siamo al limite della dose di radioterapia che si può somministrare ai pazienti. Per migliorare ulteriormente la sopravvivenza, c'è bisogno di nuovi metodi che migliorino l'efficacia delle radiazioni riducendo gli effetti collaterali.
Un modo per ottenere ciò è rendere le cellule tumorali più sensibili alle radiazioni, quindi quelle cellule sono più facilmente danneggiate dalla radioterapia. L'uso di nanoparticelle d'oro come radiosensibilizzatori ha mostrato risultati promettenti. Queste nanoparticelle d'oro possono essere introdotte per via endovenosa per accumularsi nel tumore sfruttando le pareti difettose dei vasi sanguigni del tumore, che tendono a perdere a causa della rapida crescita.
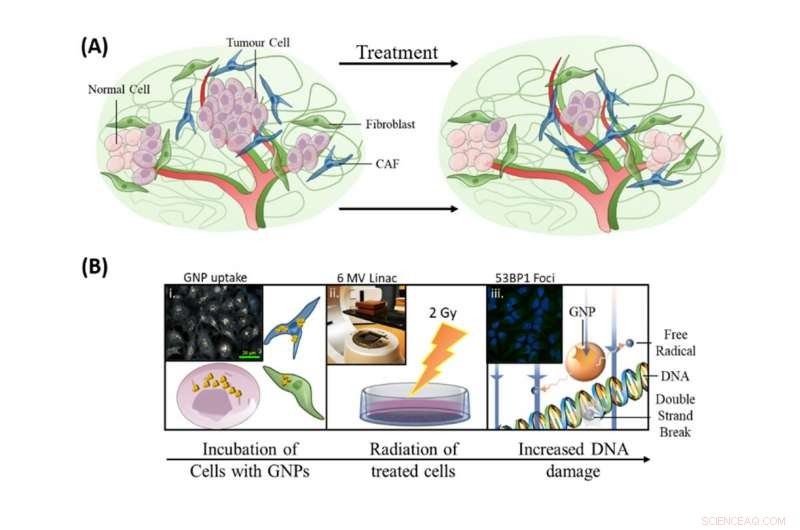
L'integrazione delle nanoparticelle d'oro negli attuali protocolli di radioterapia aveva tre obiettivi:migliorare l'uccisione delle cellule tumorali, mirare ai CAF e proteggere i fibroblasti. Credito:Bromma et al. (2020), Rapporti di fantascienza, 10, 2181., Autore fornito
Le nanoparticelle d'oro interagiscono con i fotoni a raggi X utilizzati nel trattamento con radiazioni che producono elettroni, che poi interagiscono con le molecole d'acqua per produrre radicali liberi. Questi radicali liberi possono danneggiare le cellule, riducendo la sopravvivenza di quelle cellule.
Comprendere il complesso sistema biologico presente dentro e intorno al tumore è essenziale per ottimizzare l'uso dei PNL radiosensibilizzanti, come delineato da un consorzio di laboratori, compreso il nostro laboratorio di sviluppo di nanoscienze e tecnologie presso l'Università di Victoria.
Interazioni mirate all'interno del tumore
In questo lavoro, discutiamo l'importanza di esaminare quali componenti cellulari all'interno del microambiente tumorale assorbono le nanoparticelle d'oro e diventano radiosensibilizzate. Siamo particolarmente interessati alle cellule chiamate fibroblasti attivati, che sono associati alla guarigione delle ferite e hanno proprietà antitumorali, il che significa che aiutano a combattere la crescita del tumore.
Però, i fibroblasti attivati possono essere reclutati dalle cellule tumorali, e diventano fibroblasti associati al cancro (CAF). Al posto delle proprietà antitumorali, I CAF promuovono la proliferazione e la metastasi dei tumori.
La funzione dei CAF sostiene l'idea che i tumori siano "ferite che non si rimarginano, " e prendere di mira i CAF può rivelarsi utile per migliorare i risultati del trattamento del cancro.

Accumulo di nanoparticelle d'oro (rosso) nell'ambiente tumorale. Credito:Bromma et al. (2020), Rapporti di fantascienza, 10, 2181., Autore fornito
Come illustrato nell'immagine sopra, la nostra ricerca sull'incorporazione di nanoparticelle d'oro negli attuali protocolli di radioterapia aveva tre obiettivi:migliorare l'uccisione delle cellule tumorali, mirare ai CAF e proteggere i fibroblasti.
Affinché la radiosensibilizzazione sia efficace nel migliorare il trattamento con radiazioni, le cellule bersaglio del trattamento (quelle associate alla crescita del cancro) devono avere un elevato assorbimento delle particelle radiosensibilizzanti, mentre le cellule benefiche devono avere un basso assorbimento. Ciò rende le cellule mirate più facilmente distrutte dalla radioterapia a dosi che i pazienti possono tollerare.
Questi risultati utilizzando tumori 3D cresciuti in laboratorio sono molto incoraggianti. I CAF hanno avuto il più grande assorbimento delle nanoparticelle d'oro per cellula, con quasi il triplo di quello delle cellule cancerose, mentre i fibroblasti avevano un numero relativamente piccolo. Ciò si è tradotto anche in un maggiore aumento del danno al DNA nei CAF rispetto agli altri tipi di cellule, riducendo l'attività dei CAF e rallentando la crescita del tumore.
Questa differenza nel danno al DNA dovuto al targeting selettivo delle cellule associate al cancro rispetto alle cellule normali può consentire alle nanoparticelle d'oro di essere uno strumento efficace nella futura radioterapia del cancro, contribuendo a ridurre al minimo i danni ai tessuti normali migliorando la dose di radioterapia locale al tumore.
Questo studio mostra che l'uso di nanoparticelle d'oro come radiosensibilizzatore consente di propagare più danni ai CAF, un elemento che ha dimostrato di essere largamente influente nella progressione del cancro. Riteniamo che questo lavoro costituirà una pietra miliare verso un regime di trattamento più efficace nel prossimo futuro. Costruire un modello in grado di rappresentare con precisione le diverse interazioni che avvengono all'interno del microambiente del tumore è essenziale per migliorare i risultati del trattamento per i pazienti.
Questo articolo è stato ripubblicato da The Conversation con una licenza Creative Commons. Leggi l'articolo originale. 