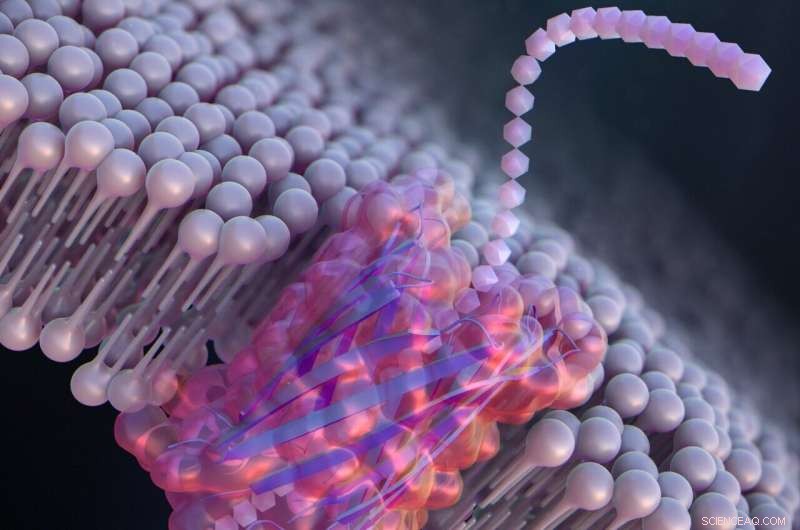
Progettazione de novo di un nanoporo per il rilevamento di una singola molecola che incorpora un peptide β-tornante. Credito:Ryuji Kawano, Università di agricoltura e tecnologia di Tokyo
I ricercatori in Giappone hanno progettato i primi peptidi progettati dal basso verso l'alto, comprendenti catene di amminoacidi, che possono formare nanopori artificiali per identificare e consentire la selezione di singole molecole di materiale genetico in una membrana lipidica.
I nanopori biologici sono generalmente canali costituiti da proteine che formano pori, in grado di rilevare molecole specifiche, ma tali canali naturali sono difficili da identificare, limitando le applicazioni proposte nel sequenziamento del DNA rapido ea basso costo, nel rilevamento di piccole molecole e altro ancora.
"Il rilevamento dei nanopori è un potente strumento per il rilevamento di singole molecole senza etichetta", ha affermato l'autore corrispondente Ryuji Kawano, professore alla Tokyo University of Agriculture and Technology (TUAT) in Giappone. "Questa è la prima volta che DNA e polipeptidi sono stati rilevati utilizzando un nanoporo progettato de novo."
Hanno pubblicato le loro scoperte il 22 novembre su Nature Nanotechnology .
I nanopori progettati de novo sono costruiti "da zero", secondo Kawano, e hanno il potenziale per imitare le proteine naturali e la loro capacità di rilevare proteine specifiche. Fondamentalmente, ha detto Kawano, possono anche essere progettati per agire come macchine molecolari artificiali in grado di rilevare una gamma molto più ampia di molecole, il che può aiutare a chiarire la connessione tra struttura e funzione nelle proteine bersaglio.
"La struttura ripiegata delle proteine è determinata dalla loro sequenza polipeptidica lineare e dà origine a una funzionalità proteica specifica", ha detto Kawano, osservando che tutte le proteine hanno una struttura e una dimensione uniche. "La struttura primaria unica è il risultato dell'evoluzione strutturale come la mutazione e la selezione di residui di amminoacidi nel tempo. Rivelare la relazione tra questa informazione primaria e la struttura proteica è uno degli obiettivi finali della scienza."
Per sviluppare grandi nanopori sintetici in grado di rilevare e identificare meglio le molecole per applicazioni pratiche, Kawano e il team hanno progettato un peptide chiamato SV28. Con due bracci di amminoacidi piegati ad angolo acuto e cariche specifiche al capolinea, l'orientamento del peptide a forma di forcina può essere controllato con precisione applicando una tensione. Il peptide può assemblarsi per formare strutture di nanopori di dimensioni comprese tra 1,7 e 6,3 nanometri, adatte per rilevare molecole di DNA.
I ricercatori hanno anche modificato SV28 aggiungendo una mutazione che fa piegare e torcere la struttura del peptide in modi specifici. Il peptide risultante formava pori uniformemente dispersi di 1,7 nanometri ciascuno, in grado di rilevare una singola catena polipeptidica o metà di una proteina.
Questo risultato potrebbe essere applicato per facilitare la comprensione della relazione tra struttura e funzione delle proteine.
Per i prossimi passi, il team prevede di progettare vari peptidi e proteine per costruire diversi tipi di nanopori per aiutare nel sequenziamento dei peptidi, operare come robot molecolari e altro ancora. + Esplora ulteriormente