Il glicerolo, un importante sottoprodotto della raffinazione della biomassa che rappresenta circa il 10% della resa, rappresenta una sfida significativa a causa del suo surplus globale. La presenza di più gruppi idrossilici attivi nel glicerolo svela un vasto potenziale per la produzione di sostanze chimiche di alto valore. L'acido formico (FA), un prodotto chiave della conversione del glicerolo, è una materia prima chimica organica fondamentale con una forte domanda in settori come pesticidi, prodotti farmaceutici ed energia.
L’ossidazione del glicerolo in FA non solo mitiga gli sprechi causati dal surplus di risorse, ma soddisfa anche le esigenze future delle celle a combustibile FA. Attualmente, la produzione industriale di AF si basa principalmente sul metanolo derivato dal petrolio e dal gas naturale, rendendo la conversione elettrocatalitica del glicerolo derivato dalla biomassa in AF altamente promettente.
Tuttavia, l'ossidazione elettrocatalitica della reazione del glicerolo (RGOR) è complessa e coinvolge deidrogenazione, adsorbimento/desorbimento e rottura dei legami C-C degli intermedi di reazione, ponendo sfide all'efficienza e alla selettività della reazione.
Recentemente, un gruppo di ricerca guidato dal Prof. Kai Yan dell'Università Sun Yat-sen, Cina, utilizzando una combinazione di calcoli della teoria del funzionale della densità (DFT) e metodi sperimentali, ha svelato il ruolo cruciale della specie attiva OH* nel processo EGOR nella produzione di FA. L'analisi DFT, partendo da una prospettiva termodinamica, ha studiato il meccanismo di OH* nel processo EGOR.
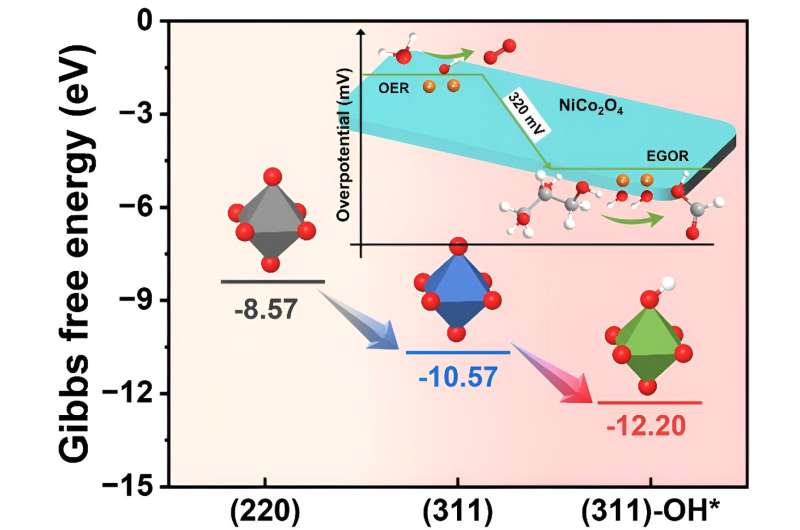
Si è scoperto che le specie OH* superficiali, riducendo l'energia di adsorbimento del glicerolo sul NiCo2 O4 superficie del catalizzatore (da -12,20 a -10,57 eV), ha facilitato il processo EGOR e ottimizzato la fase di determinazione della velocità (RDS) alterando l'energia di adsorbimento degli intermedi, passando dalla deidrogenazione meno efficiente dell'acido glicerico alla fase di deidrogenazione più efficiente dell'acido gliceraldeide.
Inoltre, l'energia di adsorbimento di OH* durante il processo EGOR era significativamente inferiore rispetto al processo di reazione di evoluzione dell'ossigeno (OER) (0,66 contro 2,70 eV), indicando la presenza preferenziale di EGOR rispetto a OER.
Inoltre, le prestazioni di un NiCo2 meticolosamente progettato O4 elettrodo in EGOR è stato studiato mediante metodi elettrochimici. In un elettrolita misto di 1 mol L -1 KOH e 0,1 mol L -1 glicerolo, il potenziale di inizio dell'elettrodo è sceso a 1,16 VRHE , superando significativamente l'OER. Anche gli esperimenti con l'elettrodo ad anello rotante (RRDE) hanno confermato la presenza preferenziale di EGOR, in linea con i risultati dell'analisi DFT.
Sulla base del meccanismo convenzionale di trasferimento degli elettroni accoppiati a protoni, sono stati studiati due possibili percorsi di ossidazione elettrochimica (percorso di ossidazione diretta e percorso di ossidazione indiretta) di OH* utilizzando metodi di potenziamento multifase e di risonanza elettronica simultanea. I risultati sperimentali hanno dimostrato che le prestazioni eccezionali del NiCo2 O4 elettrodo in EGOR è strettamente correlato alla generazione in situ di OH* che partecipa direttamente alla reazione.
In un test di stabilità del ciclo a lungo termine di 120 ore, il catalizzatore ha mostrato anche un tasso di conversione del glicerolo efficiente e stabile (89%) e una selettività dell'acido formico (70%). Questo lavoro fornisce preziose indicazioni e approfondimenti per la progettazione e lo sviluppo di catalizzatori efficienti e stabili per l'ossidazione del glicerolo. I risultati sono stati pubblicati sul Chinese Journal of Catalysis .
Ulteriori informazioni: Yan Duan et al, Integrazione della previsione teorica e dell'elettroossidazione sperimentale del glicerolo su NiCo2 O4 nanofogli, Giornale cinese di catalisi (2024). DOI:10.1016/S1872-2067(23)64585-1
Fornito dall'Accademia cinese delle scienze