I recettori chimerici dell'antigene (CAR) sono proteine di membrana sintetizzate che consentono ai linfociti di riconoscere e rispondere agli antigeni specifici delle cellule bersaglio. Nonostante l'impressionante efficacia della terapia cellulare CAR-T nel trattamento del linfoma o della leucemia a cellule B, il processo di produzione costoso e complesso ha ostacolato la sua diffusa applicazione clinica.
Precedenti ricerche hanno esplorato l’uso di nanoparticelle per fornire acidi nucleici per programmare le cellule T circolanti in vivo, ottimizzando la generazione di cellule CAR-T ed ovviando alla necessità di isolare le cellule T dai pazienti. Nel frattempo, l'inserimento della proteina CAR direttamente nella membrana delle cellule T potrebbe rappresentare un metodo semplice, evitando complicazioni come la sindrome da rilascio di citochine (CRS) e il rischio tumorigenico associato all'inserimento casuale di geni virali nel genoma.
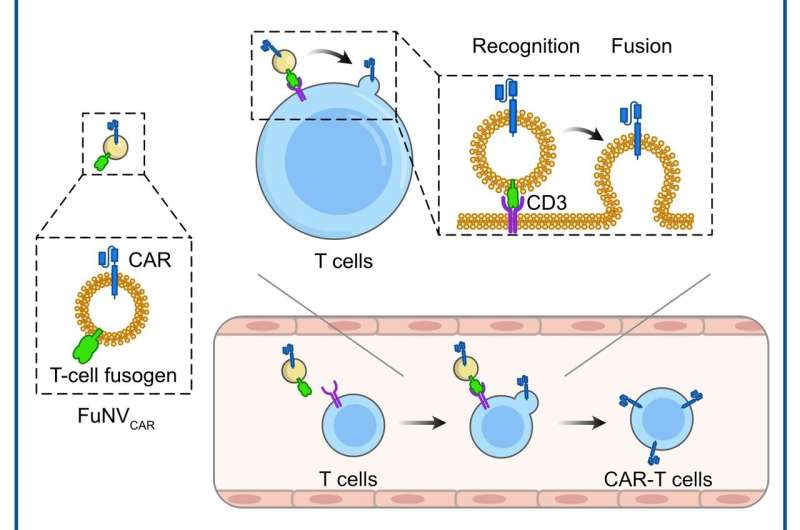
Guidati dal Prof. Jun Wang e dal Prof. Cong-Fei Xu della School of Biomedical Sciences and Engineering presso la South China University of Technology, i ricercatori hanno sviluppato una promettente strategia che prevede la fusione diretta di molecole CAR, pre-espresse su nanovescicole fusogeniche (FuNVs), alle cellule T, costruendo così cellule CAR-T in vivo.
Hanno progettato il fusogeno delle cellule T aggiungendo un frammento variabile a catena singola anti-CD3 al reovirus o al fusogeno del virus del morbillo. Hanno dimostrato che i FuNV derivati da cellule che esprimono fusogeno delle cellule T trasportavano una quantità sostanziale di fusogeno delle cellule T, che induceva in modo efficiente la fusione tra NV e cellule T sia in vitro che in vivo.
Successivamente, considerando il successo clinico delle cellule CAR-T anti-CD19 (αCD19), le cellule ingegnerizzate che esprimono il fusogeno delle cellule T e la proteina CAR αCD19 sono state costruite per produrre FuNV che trasportano CAR αCD19 (FuNVCAR ). La produzione di cellule CAR-T è stata ottenuta con successo fornendo la proteina CAR alle cellule T tramite FuNVCAR in vitro e in vivo. Nel frattempo, iniezione endovenosa di FuNVCAR ha inibito efficacemente la crescita del linfoma a cellule B.
Per esplorare ulteriormente la potenziale tossicità di FuNVCAR , l'emocromo e le analisi biochimiche del siero sono state condotte a 2 e 14 giorni, dimostrando la comparabilità con il gruppo di controllo. Durante tutto il trattamento con FuNVCAR , nei topi non sono state osservate alterazioni significative del peso corporeo.
Inoltre, a differenza del tradizionale trattamento con cellule CAR-T, il trattamento con FuNVCAR non ha indotto un elevato rilascio di citochine infiammatorie. Questa differenza osservata può essere attribuita alle cellule CAR-T transitorie prodotte da FuNVCAR , che subisce un'attivazione limitata e temporanea, mitigando il rilascio prolungato di citochine infiammatorie.
In sintesi, questo studio introduce un nuovo approccio per la produzione di cellule CAR-T in vivo attraverso il rilascio di proteine CAR mediate da FuNV. È essenziale notare, tuttavia, che questa strategia potrebbe non essere adatta a pazienti con funzione delle cellule T compromessa.
I risultati sono pubblicati sulla rivista Science Bulletin .
Ulteriori informazioni: Gui Zhao et al, Produzione in vivo di cellule CAR-T utilizzando nanovescicole fusogeniche virus-mimetiche, Science Bulletin (2023). DOI:10.1016/j.scib.2023.11.055
Fornito da Science China Press