I vaccini e le terapie basati sull'RNA messaggero potrebbero essere somministrati più facilmente grazie a un polimero non tossico che protegge l'RNA e ne controlla il rilascio all'interno delle cellule.
L'avvento dei vaccini che utilizzano l'RNA messaggero (mRNA) per dirigere la sintesi proteica immunogenica, nota soprattutto nei vaccini contro il COVID-19, sta stimolando i ricercatori a trovare modi migliori per mantenere stabile l'mRNA e rilasciarlo in modo efficace.
Un team dell’Università di Tokyo, con collaboratori in Giappone e Cina, ha ora sviluppato polimeri in grado di interagire, stabilizzare e racchiudere l’mRNA, consentendo un rilascio altamente efficace nelle cellule umane in coltura e nelle cellule di topi vivi. Hanno pubblicato il loro lavoro sulla rivista Science and Technology of Advanced Materials .
"Oltre ai vaccini per le malattie infettive, l'mRNA presenta strade promettenti per trattamenti senza precedenti come le terapie sostitutive delle proteine, l'editing genetico e le immunoterapie", afferma Horacio Cabral del team dell'Università di Tokyo. "Ma per sfruttare appieno il potenziale di queste terapie avanzate, lo sviluppo di sistemi di trasporto sicuri ed efficaci è fondamentale."
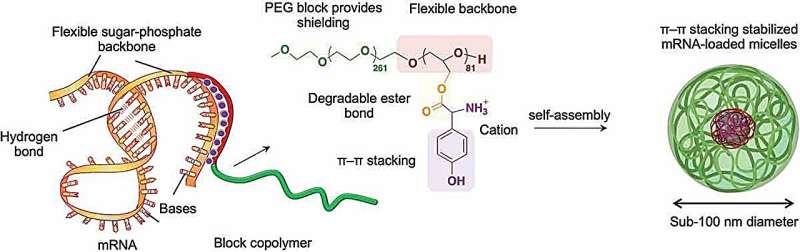
I ricercatori hanno studiato modi per mettere a punto la struttura delle loro molecole polimeriche per consentire loro di interagire con l'mRNA per proteggerlo. I polimeri biocompatibili e non tossici erano del tipo chiamato copolimeri a blocchi, costituiti da segmenti alternati di diversi gruppi chimici, in questo caso polietilenglicole e poliglicerolo.
Ma la chiave per ottenere un’adeguata interazione con l’mRNA è stata quella di collegare specifici gruppi di amminoacidi caricati positivamente alla lunga spina dorsale polimerica. La carica positiva generalmente attrae il polimero verso l’RNA carico negativamente e gli amminoacidi scelti sono anche in grado di interagire con parti dell’mRNA in un processo chiamato impilamento pi–pi (π–π). Ciò comporta interazioni tra gli elettroni in una caratteristica chiamata legami pi in anelli molecolari ciclici impilati fianco a fianco nelle molecole interagenti.
"Si tratta di un approccio altamente personalizzabile, che consente la messa a punto delle interazioni del nostro polimero con l'mRNA", afferma Cabral. Di conseguenza, l'mRNA è stato stabilizzato in modo estremamente efficace, superando il grave inconveniente dell'instabilità riscontrato con approcci alternativi.
Il polimero e l’mRNA si sono assemblati spontaneamente in fasci sferici – micelle – che hanno effettivamente trasportato il carico di mRNA nelle cellule in coltura e anche nelle cellule di topo dopo l’iniezione intramuscolare. L'mRNA veniva prontamente rilasciato all'interno delle cellule per generare le proteine che codificava con alta efficienza e per un tempo significativamente più lungo rispetto agli approcci alternativi.
"Questo lavoro è stato molto impegnativo a causa della natura delicata dell'mRNA, una molecola estremamente fragile che necessita di protezione all'esterno delle cellule bersaglio ma di esposizione immediata al meccanismo cellulare una volta all'interno", afferma Cabral. Aggiunge:"Il nostro successo è entusiasmante grazie al suo potenziale di trasformare le tecnologie di rilascio dell'mRNA, consentendo un'ingegneria precisa, strategie di rilascio innovative e superando le barriere critiche per migliorare la stabilità e l'efficacia delle terapie basate sull'mRNA."
Ulteriori informazioni: Wenqian Yang et al, I catomeri a blocchi con gruppi tirosinati idrolizzabili affiancati migliorano il rilascio di mRNA in vivo tramite assemblaggio micellare assistito da impilamento π–π, Scienza e tecnologia dei materiali avanzati (2023). DOI:10.1080/14686996.2023.2170164
Informazioni sul giornale: Scienza e tecnologia dei materiali avanzati
Fornito dall'Istituto nazionale per la scienza dei materiali