I vaccini a RNA messaggero (mRNA) stanno rivoluzionando la terapia del cancro. Possono essere sviluppati in modo flessibile in un breve periodo di tempo, consentendo l'espressione transitoria di più antigeni per un'immunizzazione sicura ed efficiente. In ambito clinico si sta esplorando una varietà di vaccini a mRNA a beneficio dei pazienti affetti da cancro.
Tuttavia, la traduzione dei vaccini mRNA è ancora ostacolata da barriere di rilascio multistadio prima di avviare una forte immunità, tra cui una rapida eliminazione, scarso targeting verso organi linfoidi e cellule dendritiche, idrolisi catalitica e debole capacità di passare attraverso i doppi strati fosfolipidici. Inoltre, la vaccinazione con il solo mRNA difficilmente può indurre forti risposte immunitarie in assenza di adiuvanti. Resta difficile migliorare il rilascio citosolico dell'mRNA e promuoverne l'efficacia vaccinale in vivo in combinazione con adiuvanti.
Nei decenni passati, è stato segnalato che un numero enorme di nanovettori promuove l’efficacia della trasfezione di farmaci a base di acido nucleico o fornisce farmaci ai linfonodi. Questi studi forniscono caratteristiche preziose tra cui dimensioni, carica superficiale, modificazione, reattività, componenti e citotossicità per raggiungere l'obiettivo del drenaggio dei linfonodi o dell'accesso citosolico.
Le tecniche di apprendimento automatico forniscono strumenti potenti per esplorare le caratteristiche fisico-chimiche e biologiche di queste nanoparticelle e facilitano la progettazione di nanovettori con elevata efficienza. Di solito, i modelli di apprendimento automatico venivano addestrati, selezionati e ottimizzati con set di dati massicci e di alta qualità provenienti da calcoli e dati sperimentali ad alto rendimento e, a loro volta, guidavano la progettazione razionale, lo screening e l'ottimizzazione dei nanovettori.
Sfruttando i database esistenti dei nanovettori, l'apprendimento automatico può fornire informazioni sulla progettazione razionale dei nanovaccini con elevata efficienza.
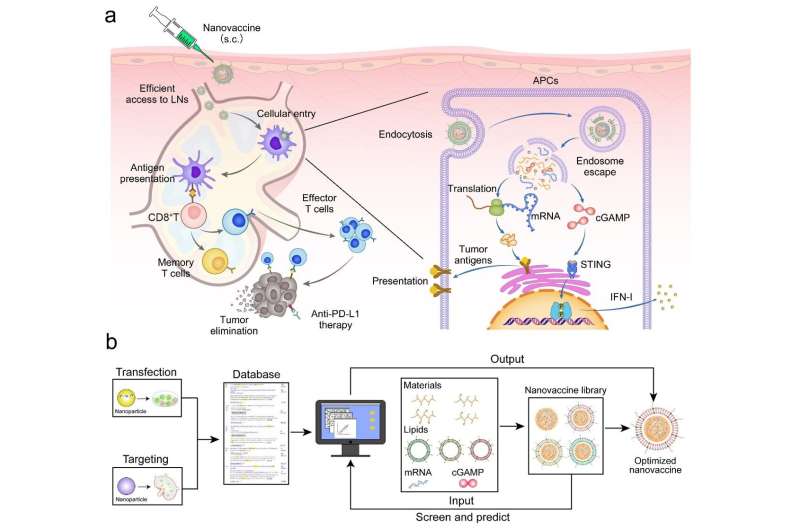
In un nuovo articolo di ricerca pubblicato sulla National Science Review , gli scienziati dell'Accademia cinese delle scienze e dell'Università Jiao Tong di Shanghai hanno utilizzato l'apprendimento automatico per guidare la progettazione razionalizzata dei nanovaccini a mRNA. Questo studio ha identificato i parametri chiave dei nanovaccini per un rilascio efficiente di mRNA e cGAMP sulla base di un modello di apprendimento automatico del database Nanocarrier.
I nanocomplessi mRNA/cGAMP a base di polietilenimmina innestata con acido fenilboronico sono stati preparati e ulteriormente incapsulati con lipidi anionici per ottenere il nanovaccino.
(1) La carica superficiale negativa del nanovaccino riduce l'interazione con i glicosaminoglicani caricati negativamente nella matrice e migliora l'accumulo nei linfonodi.
(2) Il nanovaccino, dopo essere stato internalizzato dalle cellule presentanti l'antigene (APC) nei linfonodi, promuove il rilascio di mRNA e cGAMP dagli endosomi al citoplasma, che attiva la via STING e induce la presentazione di antigeni tumorali.
(3) L'attivazione della via STING promuove il rilascio di IFN-I, che attiva la risposta immunitaria delle cellule T per uccidere le cellule tumorali e inibire la crescita e le metastasi del tumore. Rispetto al solo mRNA, la strategia terapeutica basata su questo nanovaccino ha dimostrato effetti antitumorali più forti nei modelli di melanoma e cancro del colon-retto.
L'articolo è pubblicato sulla rivista National Science Review .
Ulteriori informazioni: Lei Zhou et al, Immunizzazione con mRNA potenziata da agonisti di STING tramite la progettazione intelligente di nanovaccini per migliorare l'immunoterapia antitumorale, National Science Review (2023). DOI:10.1093/nsr/nwad214
Fornito da Science China Press