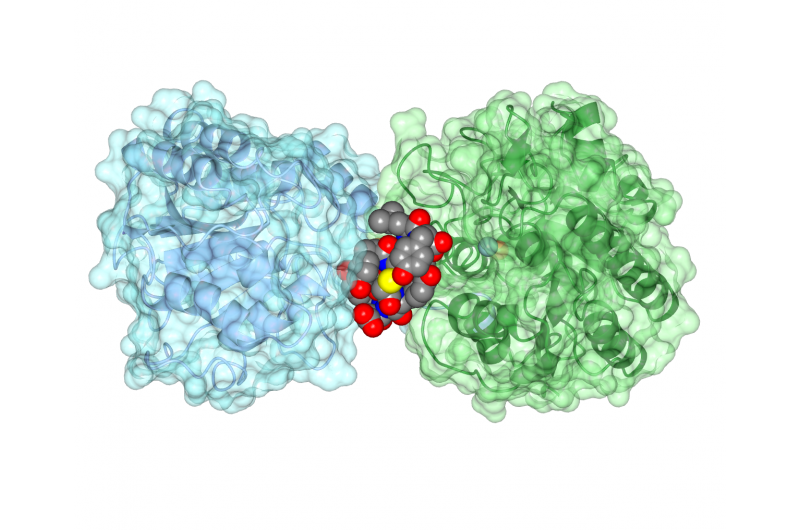
Il peptide ciclico ipglicermide si lega a un enzima iPGM, bloccandone l'attività. Credito:Jim Inglese, NCATS
I gruppi di ricerca del National Institutes of Health e all'estero hanno identificato il primo inibitore di un enzima a lungo ritenuto un potenziale bersaglio farmacologico per combattere parassiti e batteri che causano malattie. Le squadre, guidato dal National Center for Advancing Translational Sciences (NCATS) del NIH e dagli scienziati dell'Università di Tokyo, ordinato attraverso più di 1 trilione di piccoli frammenti proteici chiamati peptidi ciclici per scoprire due che potrebbero spegnere l'enzima. Il ritrovamento, segnalato il 3 aprile 2017 in Comunicazioni sulla natura , potrebbe gettare le basi per il potenziale sviluppo di nuovi tipi di farmaci antimicrobici.
L'esperienza di NCATS nella fase iniziale, la scoperta di molecole precliniche ha aiutato i team a trovare potenziali farmaci candidati che potrebbero avere implicazioni per milioni di persone in tutto il mondo.
"Il lavoro è un'eccellente dimostrazione di come NCATS adempia alla sua missione di fornire miglioramenti nei processi di traduzione, " disse Anton Simeonov, dottorato di ricerca, direttore scientifico, NCATS Divisione di Innovazione Preclinica. "Gli scienziati hanno dimostrato che un obiettivo terapeutico, precedentemente considerato non farmacologico dalle aziende farmaceutiche, è in realtà drogabile attraverso un agente terapeutico non tradizionale."
L'enzima bersaglio, fosfoglicerato mutasi cofattore-indipendente (iPGM), si trova sia nei parassiti che nei batteri. Diversi tipi di nematodi parassiti hanno iPGM, tra cui Brugia malayi e Onchocerca volvulus, che infettano circa 150 milioni di persone che vivono principalmente nelle regioni tropicali. Questi parassiti possono causare malattie infettive devastanti, come la cecità fluviale. L'enzima si trova anche nei batteri, compreso lo Staphylococcus aureus, che può causare l'infezione trasmessa in ospedale da MRSA (Staphylococcus aureus resistente alla meticillina), e Bacillus anthracis, che provoca l'antrace.
"Diversi organismi infettivi sono potenzialmente sensibili a un inibitore di iPGM, " ha detto l'autore corrispondente James Inglese, dottorato di ricerca, direttore, Laboratorio di tecnologia per lo sviluppo e lo screening di saggi NCATS. "Il team ha soprannominato i peptidi inibitori 'ipglicermidi, ' che rappresentano una potente classe di inibitori di iPGM. In teoria, un farmaco del genere potrebbe diventare un trattamento antiparassitario e antibatterico ad ampio spettro".
Attuali farmaci antiparassitari, come l'ivermectina, lavorano principalmente sui primi stadi larvali del verme. Tale trattamento deve essere somministrato annualmente o semestralmente fino a un decennio. Per anni, gli scienziati hanno cercato di trovare un farmaco più efficace che funzionasse anche contro il verme adulto e le fasi successive dell'infezione. Studi precedenti dei collaboratori di Inglese al New England Biolabs di Ipswich, Massachusetts, hanno dimostrato che l'iPGM è uno dei tanti enzimi essenziali di cui il nematode ha bisogno per sopravvivere. Fa parte di un comune processo biologico chiamato glicolisi, che aiuta a produrre energia per le cellule. Mentre lo stesso importante processo avviene nelle cellule umane, si basa su una forma diversa dell'enzima. Di conseguenza, un farmaco che prende di mira l'iPGM e uccide il nematode probabilmente lascerebbe in pace la controparte umana. Tale farmaco potrebbe funzionare su tutte le fasi della vita del verme, e l'infezione potrebbe essere trattata in modo acuto, simile a un antibiotico. Però, i loro precedenti tentativi di trovare un composto per bloccare l'enzima sono falliti.
Gli enzimi sono proteine che avviano le reazioni chimiche. La maggior parte degli enzimi ha "siti attivi" a forma di tasca in cui si inserisce una molecola, e su cui agisce l'enzima. I farmaci a piccole molecole possono adattarsi ai siti attivi e prevenire, o inibire, l'enzima dal fare il suo lavoro biologico. Ma iPGM e altri enzimi simili sono diversi. iPGM ha una vita breve, sito attivo temporaneo, rendendo praticamente impossibile trovare un farmaco a piccola molecola in grado di bloccare l'enzima.
A causa del design insolito dell'enzima, il team guidato da NCATS ha cercato un tipo diverso di farmaco rispetto ai tipici farmaci a piccole molecole. Inglese ha collaborato con l'autore corrispondente Hiroaki Suga, dottorato di ricerca, presso l'Università di Tokyo, per costruire una miscela di librerie di oltre 1 trilione di piccoli peptidi. La squadra ha fatto un passo avanti, aggiungendo un amminoacido ai peptidi per creare peptidi ciclici a forma di anello, che gli scienziati hanno ipotizzato avrebbe la forma e la struttura necessarie per attaccarsi alla superficie dell'enzima e disabilitare l'enzima.
I ricercatori hanno setacciato ripetutamente i peptidi ciclici per trovare quale si attaccasse maggiormente all'enzima. Hanno trovato due peptidi ciclici che si legano strettamente solo all'enzima iPGM e ne interrompono l'attività.
Il team ha successivamente lavorato con biologi strutturali presso l'Università del Kansas, Lawrence, per determinare la struttura della disposizione del peptide ciclico iPGM, mostrando come il peptide ha impedito all'enzima di funzionare correttamente. "Il peptide ciclico ha un'affinità sorprendentemente stretta e selettiva per iPGM, come un anticorpo, " disse Inglese.
I prossimi passi del gruppo saranno trovare modi per far entrare i peptidi ciclici nelle cellule. "Se riusciamo a trovare il modo di inserire peptidi ciclici nelle cellule, allora questo aprirebbe nuovi bersagli che i farmaci a piccole molecole hanno difficoltà ad affrontare, Inglese ha detto. "Ipglicermidi rappresentano un paesaggio fertile ma incolto tra farmaci a piccole molecole e proteine biologiche".