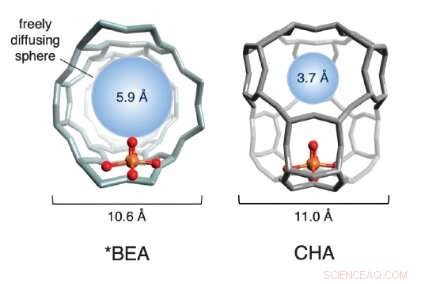
Un'illustrazione delle strutture a gabbia di due zeoliti a base di ferro utilizzate nello studio. Le sfere rosse e dorate (che rappresentano ossigeno e ferro, rispettivamente) costituiscono il sito attivo. La struttura a gabbia, in grigio, è formato da silicio, alluminio e ossigeno. La sfera blu quantifica la dimensione della molecola più grande che può diffondersi liberamente dentro e fuori la gabbia del sito attivo (il diametro del metano è ~4.2 ). Credito:Benjamin Snyder
Un team di ricercatori dell'Università di Stanford e dell'Università di Leuven in Belgio ha ulteriormente chiarito un processo intrigante che potrebbe essere un passo importante verso un'economia del carburante a metanolo con abbondante metano come materia prima, un progresso che potrebbe cambiare radicalmente il modo in cui il mondo utilizza il gas naturale.
Il metanolo, l'alcol più semplice, viene utilizzato per realizzare vari prodotti, come vernici e plastiche, e come additivo alla benzina. Ricco di idrogeno, il metanolo può guidare le celle a combustibile di nuova generazione che potrebbero produrre significativi benefici ambientali.
Se il gas naturale, di cui il metano è il componente principale, potrebbe essere convertito economicamente in metanolo, il combustibile liquido risultante sarebbe immagazzinato e trasportato molto più facilmente del gas naturale e dell'idrogeno puro. Ciò ridurrebbe notevolmente anche le emissioni di metano dagli impianti di trattamento del gas naturale e dalle condutture. Oggi, metano fuoriuscito, un gas serra molte volte più potente dell'anidride carbonica, nega quasi i vantaggi ambientali del gas naturale rispetto al petrolio e al carbone. Il nuovo studio del team nell'attuale edizione di Scienza è il loro ultimo ad avanzare un modo a basso consumo energetico per produrre metanolo dal metano.
"Questo processo utilizza cristalli comuni noti come zeoliti di ferro che sono noti per convertire il gas naturale in metanolo a temperatura ambiente, " spiega Benjamin Snyder, che ha conseguito il dottorato a Stanford studiando catalizzatori per affrontare gli aspetti chiave di questa sfida. "Ma, questa è una chimica estremamente impegnativa da raggiungere a livello pratico, poiché il metano è ostinatamente chimicamente inerte."
Quando il metano viene infuso nelle zeoliti di ferro porose, il metanolo viene prodotto rapidamente a temperatura ambiente senza bisogno di calore o energia aggiuntivi. A confronto, il processo industriale convenzionale per produrre metanolo dal metano richiede temperature di 1000°C (1832°F) e pressioni estremamente elevate.
"Questo è un processo economicamente allettante, ma non è così facile. Barriere significative impediscono di portare questo processo a livelli industriali, " disse Edward Salomone, Professore di Stanford di chimica e di scienza dei fotoni presso lo SLAC National Accelerator Laboratory. Solomon è l'autore senior del nuovo studio.
Tenere accese le zeoliti
Sfortunatamente, la maggior parte delle zeoliti di ferro si disattiva rapidamente. Impossibile elaborare più metano, il processo si esaurisce. Gli scienziati sono stati desiderosi di studiare modi per migliorare le prestazioni della zeolite di ferro. Il nuovo studio, co-autore di Hannah Rhoda, un dottorando di Stanford in chimica inorganica, utilizza la spettroscopia avanzata per esplorare la struttura fisica delle zeoliti più promettenti per la produzione di metano-metanolo.

Hannah Rhoda con l'apparecchiatura di spettroscopia di risonanza Raman, che spara un laser in un campione per ottenere informazioni vibrazionali dall'esatto sito studiato. I ricercatori nel presente studio hanno utilizzato questa tecnica per aiutare ad assegnare i siti avvelenati da Fe(III)-OH e Fe(III)OCH3, che illuminava il meccanismo. Credito:Hannah Rhoda
"Una domanda chiave qui è come far uscire il metanolo senza distruggere il catalizzatore, " ha detto Rhoda.
Scegliendo due attraenti zeoliti di ferro, il team ha studiato la struttura fisica dei reticoli attorno al ferro. Hanno scoperto che la reattività varia notevolmente in base alle dimensioni dei pori nella struttura cristallina circostante. Il team si riferisce ad esso come "effetto gabbia, " poiché il reticolo incapsulante assomiglia a una gabbia.
Se i pori nelle gabbie sono troppo grandi, il sito attivo si disattiva dopo un solo ciclo di reazione e non si riattiva mai più. Quando le aperture dei pori sono più piccole, però, coordinano una precisa danza molecolare tra i reagenti ei siti attivi del ferro, che produce direttamente metanolo e rigenera il sito attivo. Sfruttando questo cosiddetto "effetto gabbia, ' il team è stato in grado di riattivare ripetutamente il 40% dei siti disattivati, un significativo progresso concettuale verso un processo catalitico su scala industriale.
"Il ciclo catalitico - la continua riattivazione dei siti rigenerati - potrebbe un giorno portare a continui, produzione economica di metanolo da gas naturale, " ha detto Snyder, ora un borsista post-dottorato presso l'UC-Berkeley nel Dipartimento di Chimica sotto Jeffrey R. Long.

Benjamin Snyder (a destra) e il suo ex consigliere di dottorato, Edoardo Salomone, professore di chimica a Stanford e di scienza dei fotoni allo SLAC. Credito:Linda A. Cicerone
Questo fondamentale passo avanti nella scienza di base aiuterà a chiarire ai chimici e agli ingegneri chimici il processo utilizzato dalle zeoliti di ferro per produrre metanolo a temperatura ambiente, ma resta ancora molto lavoro prima che un tale processo possa essere industrializzato.
Il prossimo passo nella lista di Snyder:affrontare il raggiungimento del processo non solo a temperatura ambiente ma utilizzando l'aria ambiente piuttosto che qualche altra fonte di ossigeno, come il protossido di azoto utilizzato in questi esperimenti. Trattare con un potente agente ossidante come l'ossigeno, che è notoriamente difficile da controllare nelle reazioni chimiche, sarà un altro notevole ostacolo lungo il percorso.
Per adesso, Snyder era sia soddisfatto che stupito dai poteri illustrativi della sofisticata strumentazione spettroscopica nei laboratori Solomon che sono stati sfruttati per questo studio. Questi erano inestimabili per la sua comprensione della chimica e delle strutture chimiche coinvolte nel processo da metano a metanolo.
"È fantastico come puoi ottenere una visione molto potente a livello atomico, come l'effetto gabbia, da questi strumenti che non erano disponibili per le precedenti generazioni di chimici, " ha detto Snyder.