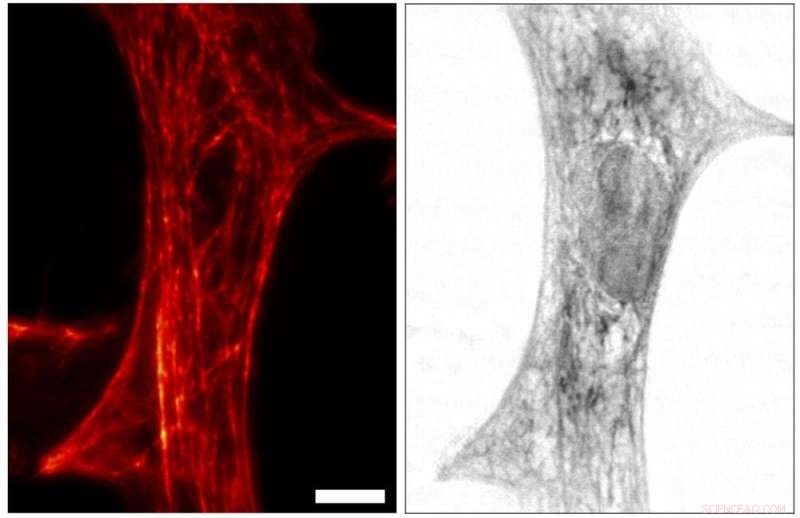
Immagine STED (a sinistra) e imaging a raggi X (a destra) della stessa cellula del tessuto cardiaco di un ratto. Per STED, la rete di filamenti di actina nella cellula, importante per le proprietà meccaniche della cellula, sono stati etichettati con un colorante fluorescente. Contrasto nell'immagine a raggi X, d'altra parte, è direttamente correlato alla densità elettronica totale, con contributi di molecole marcate e non marcate. Avendo entrambi i contrasti a portata di mano, la struttura della cellula può essere visualizzata in modo più completo, con le due modalità di imaging “informandosi a vicenda”. Credito:Università di Gottinga, M. Bernhardt et al.
Un team di ricerca dell'Università di Göttingen ha commissionato una combinazione di microscopi unica al mondo presso la sorgente di raggi X PETRA III di DESY per ottenere nuove informazioni sulle cellule biologiche. Il team guidato da Tim Salditt e Sarah Köster descrive il microscopio combinato a raggi X e a fluorescenza ottica nella rivista Comunicazioni sulla natura . Per testare le prestazioni del dispositivo installato presso la stazione di misura P10 di DESY, gli scienziati hanno studiato le cellule del muscolo cardiaco con il loro nuovo metodo.
La moderna microscopia ottica fornisce immagini sempre più nitide importanti nuove intuizioni sui processi interni delle cellule biologiche, ma la massima risoluzione si ottiene solo per la frazione di biomolecole che emettono luce di fluorescenza. Per questo scopo, piccoli marcatori fluorescenti devono essere prima attaccati alle molecole di interesse, per esempio proteine o DNA. La commutazione controllata del colorante fluorescente nel cosiddetto microscopio STED (stimulated emission depletion) consente quindi la massima risoluzione fino a pochi miliardesimi di metro, secondo il principio della commutazione ottica tra stato on e off introdotto dal premio Nobel Stefan Hell di Gottinga.
"Ma come possiamo ottenere immagini nitide di tutti i componenti cellulari, comprese quelle molecole a cui non possono essere attaccati marcatori fluorescenti, " chiede Salditt. "Come possiamo illuminare lo 'sfondo scuro' di tutte le molecole non etichettate, in cui sono incorporate le biomolecole fluorescenti specificamente etichettate?"
Il team di Salditt e Köster ha ora combinato un microscopio STED e un microscopio a raggi X, che può quasi simultaneamente mappare la fluorescenza e la distribuzione della densità del totale dei componenti cellulari nella cellula. "Inoltre, Esperimenti di diffrazione dei raggi X, che sono ben noti dalla cristallografia, può essere eseguita anche in posizioni precisamente controllate nella cella, " spiega il coautore Michael Sprung, capo della stazione di misura P10 dove è stato installato il nuovo dispositivo.
"Con questo nuovo microscopio a raggi X/STED abbiamo visualizzato prima una rete di filamenti proteici nelle cellule del muscolo cardiaco in modalità STED. Le cellule sono state poi anche riprese con l'olografia a raggi X per coprire la distribuzione spaziale della densità di massa nell'intera cellula. , compresi tutti i suoi componenti, " spiega Marten Bernhardt, autore principale dell'articolo. "Utilizzando il contrasto complementare miriamo a una comprensione più completa della struttura alla base della contrattilità e della generazione di forza nelle cellule, " aggiunge Salditt. "In futuro, vogliamo applicarlo anche per osservare i processi dinamici nelle cellule viventi, " spiega Koster, portavoce del centro di ricerca collaborativa Comportamento collettivo della materia soffice e biologica della German Science Foundation (DFG), che fornisce il quadro di ricerca degli esperimenti.