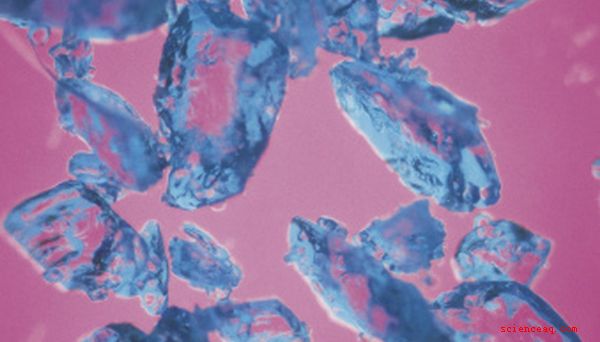
Come molti complessi di metalli di transizione, il solfato di rame (II) pentaidrato è colorato in modo brillante; i cristalli di questa bellissima sostanza sono di una pallida tonalità di blu. Il suo colore deriva dalla chimica e dalla fisica della sua composizione - o, più precisamente, dal tipo di legami che forma con gli ioni solfato e le molecole di acqua attaccate al rame.
Orbitali
Gli elettroni esibiscono un'onda- dualità delle particelle, nel senso che hanno sia proprietà ondulatorie sia proprietà particellari. Il comportamento di un elettrone in un atomo è descritto da un'equazione simile ad un'onda chiamata funzione d'onda. Il quadrato della funzione d'onda dà la probabilità che l'elettrone venga trovato in un determinato punto in un dato momento. Le funzioni d'onda degli elettroni negli atomi sono anche chiamate orbitali atomici. I chimici nominano gli orbitali atomici usando un numero per designare il livello di energia dell'orbitale seguito da una lettera per designare il tipo di orbitale. Per gli elementi del quarto periodo della tavola periodica o superiore, è necessario concentrarsi solo su tre tipi di orbitali, vale a dire, s, p e d. Per avere un'idea della forma di questi orbitali, vedere il collegamento nella sezione risorse.
Divisione del campo di cristallo
Lo ione rame nel solfato di rame (II) ha perso due elettroni, quindi ha un + 2 carica. Ha nove elettroni nel suo livello o guscio di energia più esterno; questi cosiddetti elettroni di valenza occupano tutti orbitali 3d. Le molecole d'acqua e gli ioni solfato sono attratti dalla carica positiva sullo ione rame, quindi si avvicinano e si dispongono attorno ad esso in una configurazione ottaedrica. Di conseguenza, due dei cinque orbitali 3d dello ione rame si allineano lungo gli assi con cui gli ioni solfato e le molecole d'acqua si avvicinano; poiché gli elettroni in questi orbitali e gli elettroni nelle molecole /ioni hanno entrambi una carica negativa, si respingono a vicenda. Alla fine, quindi, due dei cinque orbitali 3d hanno aumentato l'energia; questi sono chiamati ad es. orbitali. Gli altri tre, al contrario, hanno una diminuzione dell'energia e sono chiamati orbitali t2g.
Assorbimento della luce
Un complesso di coordinato verrà assorbito dal fotone se ha un'energia equivalente alla differenza tra lo stato che un elettrone ora occupa e l'energia di un altro stato a sua disposizione. Di conseguenza, il complesso solfato di rame può assorbire fotoni di luce con energie equivalenti alla differenza di energia tra t2g e ad esempio gli orbitali. In effetti, la differenza di energia per il complesso solfato di rame è equivalente alla differenza di energia per i fotoni di luce nella regione rosso-arancione dello spettro. Poiché la luce rossastra viene assorbita mentre viene trasmessa la luce blu, il solfato di rame appare blu.
Dissoluzione in acqua
Quando il solfato di rame si dissolve in acqua, gli ioni rame e solfato si dissociano. Ora lo ione rame forma un complesso ottaedrico in cui è circondato da sei molecole di acqua. L'effetto è comunque sostanzialmente lo stesso, perché la divisione tra gli orbitali t2g e, ad esempio, gli orbitali in questo nuovo complesso è ancora tale che la luce rosso-arancio viene assorbita e vedi una soluzione di colore blu.