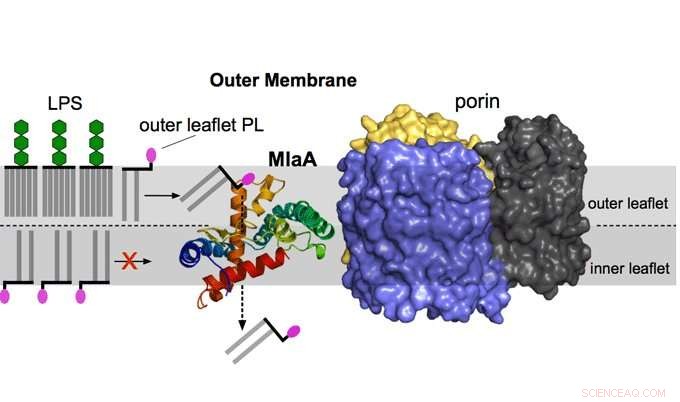
L'immagine mostra la pulizia della membrana esterna da parte di MlaA. MlaA, che nella cellula è legato a un'altra proteina della membrana esterna chiamata porina, rimuove i fosfolipidi dei lembi esterni e funziona come un aspirapolvere a membrana che mantiene l'importante barriera di permeabilità della membrana esterna. Credito:Università di Newcastle
Nuova ricerca pubblicata su Microbiologia della natura ha evidenziato una proteina che funziona come un aspirapolvere a membrana e che potrebbe essere un potenziale nuovo bersaglio per gli antibiotici.
Il team dell'Università di Newcastle rivela come la rimozione di alcuni lipidi dalla membrana esterna possa fornire una vulnerabilità per i batteri gram-negativi. Propongono che questo sistema potrebbe essere sfruttato da farmaci per diminuire la virulenza batterica, e per rendere più efficaci vari antibiotici.
Pulizia della membrana batterica
I batteri Gram-negativi come E. coli hanno due membrane, una membrana interna e una membrana esterna.
La membrana esterna è un doppio strato asimmetrico con un lembo interno di fosfolipidi e un lembo esterno composto quasi esclusivamente da lipopolisaccaride.
Il lipopolisaccaride forma uno strato ricoperto di zucchero sulla superficie dei batteri Gram-negativi che è una barriera molto efficace per grassi, molecole idrofobiche e provoca resistenza agli antibiotici e ad altri composti nocivi.
Però, i fosfolipidi del lembo interno si accumulano spontaneamente nel lembo esterno della membrana esterna, formando "isole" tra i lipopolisaccaridi che aumentano la permeabilità della membrana esterna dei composti tossici. Queste molecole di fosfolipidi devono essere rimosse dal lembo esterno per ripristinare la barriera di permeabilità della membrana esterna e l'asimmetria.
Questo processo viene eseguito dal mantenimento del sistema di asimmetria lipidica (Mla), che è presente nella maggior parte dei batteri Gram-negativi. La proteina MlaA, il fulcro della ricerca, è il componente della membrana esterna del sistema Mla.
Autore principale e professore di biologia strutturale delle proteine di membrana all'interno dell'Istituto per le bioscienze cellulari e molecolari dell'Università di Newcastle, Bert van den Berg ha spiegato:"Le nostre strutture tridimensionali e i dati funzionali mostrano che MlaA forma una ciambella nel lembo interno della membrana esterna. Questo lega i fosfolipidi dal lembo esterno e li rimuove attraverso il canale centrale, in qualche modo simile a un aspirapolvere.
"Il nostro studio illumina un processo fondamentale e importante nei batteri Gram-negativi ed è un punto di partenza per determinare se il sistema Mla dei patogeni Gram-negativi potrebbe essere preso di mira da farmaci per ridurre la virulenza batterica, e per rendere più efficaci vari antibiotici".
L'Istituto per le bioscienze cellulari e molecolari mira a sostenere e sviluppare la ricerca della più alta qualità per comprendere le caratteristiche fondamentali delle cellule funzionanti, ponendo un'enfasi speciale sui problemi rilevanti per la medicina. Il team dell'Istituto che lavora con i suoi collaboratori internazionali continuerà ora lo studio della proteina MlaA come bersaglio per gli antibiotici.