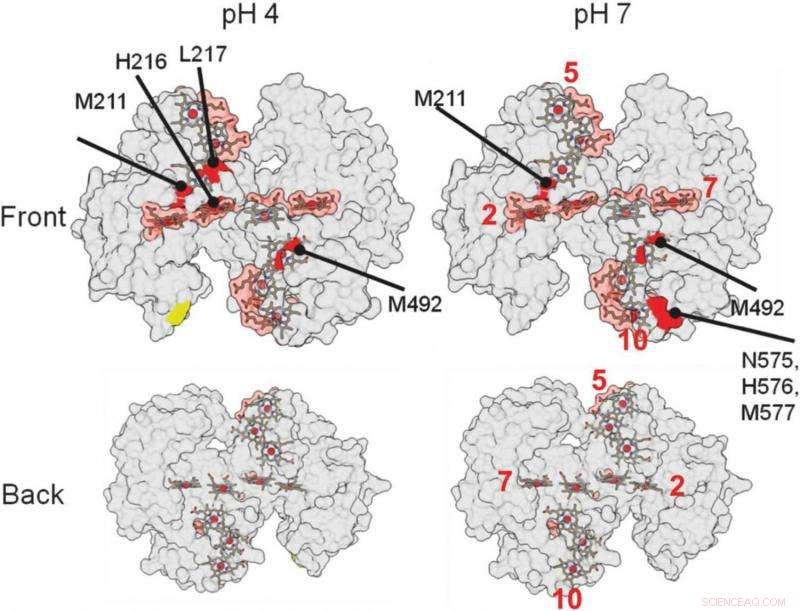
fuori su questi rendering strutturali 3-D della proteina, ha aiutato i ricercatori a identificare dove la proteina si lega a un minerale. Le aree rosse indicano possibili aree di rilegatura. Credito:Berkeley Lab
Gli scienziati hanno scoperto i dettagli di un accoppiamento non convenzionale tra una proteina batterica e un minerale che consente al batterio di respirare quando l'ossigeno non è disponibile.
La ricerca, condotto da un team di scienziati presso il Lawrence Berkeley National Laboratory (Berkeley Lab) del Dipartimento dell'Energia, potrebbe portare a nuove innovazioni nel collegamento delle proteine ad altri materiali per dispositivi elettronici a base biologica, come i sensori in grado di diagnosticare malattie o rilevare contaminanti. Potrebbe anche aiutare i ricercatori a comprendere e controllare le reazioni chimiche innescate da queste interazioni proteina-materiale.
"Spostare gli elettroni sui metalli può causare la crescita o la dissoluzione di diversi minerali. Studiare come una proteina fa questo può aiutarci a capire sia come gli organismi rimodellano il loro ambiente sia come producono biominerali per i denti o la protezione, " ha detto Caroline Ajo-Franklin, uno scienziato del personale nella struttura di nanostrutture biologiche presso la fonderia molecolare del Berkeley Lab, che è un centro di ricerca sulle nanoscienze.
Ajo-Franklin ha condotto lo studio, pubblicato online su Giornale della Società Chimica Americana all'inizio di questo mese.
"Capire come appaiono queste interazioni tra proteine e materiali può aiutarci a progettarle meglio, " lei ha aggiunto, "e darci informazioni su come connettere le cellule viventi con i dispositivi".
I ricercatori si sono affidati a una tecnica basata sui raggi X presso l'Advanced Light Source (ALS) del Berkeley Lab, noto come "impronta, "per individuare le connessioni chimiche tra la proteina batterica e le nanoparticelle composte da ferro e ossigeno.
Lo studio, che ha identificato un sito di legame sorprendentemente piccolo e debole, ha anche beneficiato di strumenti e competenze presso la Molecular Foundry del laboratorio; e il Joint BioEnergy Institute guidato dal laboratorio, specializzata nella ricerca sui biocarburanti.
La struttura di questa proteina esotica era stata precedentemente mappata in isolamento con dettagli su scala atomica da altri gruppi di ricerca utilizzando la cristallografia a raggi X, che richiedeva una forma cristallizzata della proteina. Ma gli scienziati non sapevano come si legasse al minerale contenente metallo:le tecniche convenzionali non possono vedere questo processo di legame.

Sayan Gupta, un esperto di impronte a raggi X, dimostra un tipo di portacampione che è stato utilizzato per studiare come una proteina si lega a un minerale. Credito:Paul Mueller
Nel 2014, Ajo-Franklin ha imparato da Corie Ralston, un altro ricercatore di laboratorio che lavora nella Divisione di Biofisica Molecolare e Bioimmagini Integrate (MBIB), sulla tecnica di impronta della spettrometria di massa a raggi X, un modo innovativo per sondare con precisione le proteine e l'ambiente circostante con i raggi X presso la SLA.
Ajo-Franklin e Ralston stavano perseguendo progetti separati di ricerca e sviluppo diretti dal laboratorio, e videro che i due sforzi potevano effettivamente essere complementari.
Ralston aveva adottato la tecnica dell'impronta a raggi X dal suo ex consigliere, Segna possibilità, un professore della Case Western Reserve University che ha stabilito la tecnica di impronta a raggi X al Brookhaven National Laboratory a Long Island, N.Y. Questa tecnica a raggi X è disponibile solo presso l'ALS e la National Synchrotron Light Source II di Brookhaven (NSLS-II).
"L'impronta può dirti come interagiscono le proteine, " Ha detto Ralston. "Può fornire informazioni strutturali e dinamiche sulle proteine in prossimità del loro ambiente nativo".
La proteina selezionata per lo studio proviene da un batterio metal-reducente, Shewanella oneidensis, che "mangia zucchero e fondamentalmente respira minerali" quando l'ossigeno non è disponibile, ha osservato Ajo-Franklin. "Uno dei motivi per cui questi organismi sono così divertenti da studiare è che interagiscono con un'ampia gamma di materiali".
Dopo Tatsuya Fukushima, un ex scienziato del laboratorio che è stato uno degli autori principali dello studio, trovato un modo adatto per preparare la proteina e le nanoparticelle in una soluzione liquida per studi a raggi X, Sayan Gupta, un esperto di impronte a raggi X nella divisione MBIB di Berkeley Lab, ha utilizzato una linea di raggi X presso la SLA per studiare i campioni.
"Stiamo catturando le istantanee dello stato di questa molecola in un momento particolare, " Ha detto Gupta. "È una tecnica semplice e ti dà molte informazioni sullo stato nativo di una proteina".
In questa tecnica, I raggi X producono molecole altamente reattive note come radicali idrossilici mentre passano attraverso la soluzione liquida che circonda la proteina. Questi radicali modificano la proteina in un modo che consente agli scienziati di individuare lievi variazioni chimiche in cui la proteina è in contatto con la soluzione.
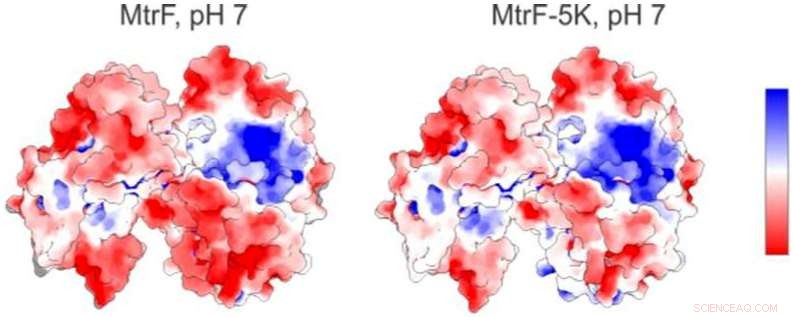
Una mappa elettrostatica (a sinistra) di una proteina studiata presso l'Advanced Light Source del Berkeley Lab mostra regioni con carica positiva (blu) e carica negativa (rosso). A destra è una mappa elettrostatica prevista per una forma mutante della proteina. Credito:Berkeley Lab
Le regioni della proteina che interagiscono con altre proteine o materiali sono protette dai radicali e non soggette alle alterazioni chimiche. Le posizioni in cui la proteina non è alterata indicano dove si verifica il legame.
Nell'ultimo studio, queste istantanee chimiche prodotte dalla tecnica dell'impronta a raggi X in diversi momenti sono state successivamente analizzate utilizzando una tecnica nota come spettrometria di massa presso il Joint BioEnergy Institute.
Un'analisi dettagliata di Fukushima ha rivelato come la proteina si collegasse al minerale.
"La scoperta più grande, è stato abbastanza sorprendente, era che le nostre proteine si legano in modo relativamente debole, " ha detto Ajo-Franklin. "La maggior parte delle proteine che si interfacciano con i materiali si legano molto strettamente, " cambiare forma mentre formano questa connessione. Questa particolare proteina non sembra cambiare forma e interagisce solo con il minerale in una piccola area, richiedendo circa cinque volte meno energia di legame, a confronto, rispetto alle proteine tipiche che formano i biominerali.
In realtà ha molto senso, lei ha aggiunto. "Il compito di questa proteina è trasferire elettroni al minerale, quindi non deve rimanere in contatto per molto tempo."
Il team di ricerca sta ora lavorando per studiare come questa e proteine simili interagiscono con una serie di minerali.
"Ci sono un sacco di proteine in questa famiglia, " Ajo-Franklin ha detto. "Siamo davvero entusiasti di vedere come queste proteine interagiscono con materiali diversi. Usano tutti la stessa strategia vincolante?"
Questo studio fornisce già idee su come riprogettare queste proteine per realizzare migliori connessioni elettroniche e quindi sensori bioelettronici più sensibili – un progetto a cui sta lavorando Ajo-Franklin.