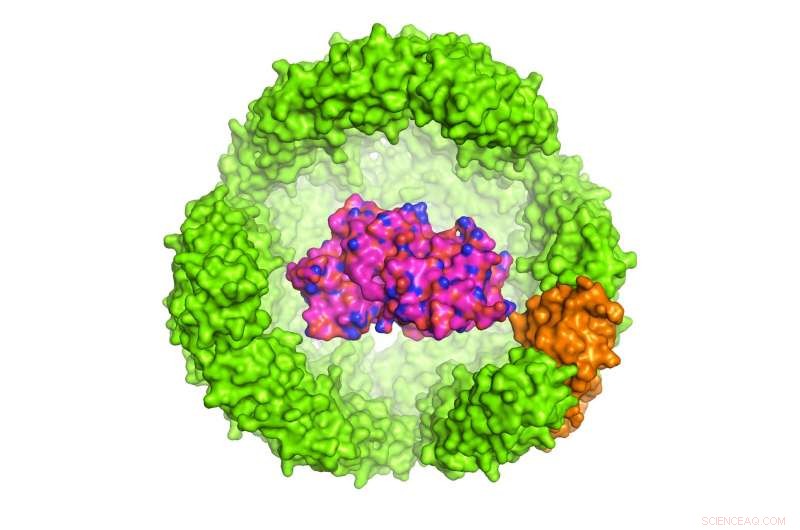
Illustrazione di una proteina di interesse (POI) all'interno di un exoshell di ferritina di Archeoglobus fulgidus a 24 subunità, che ha un diametro di 12 nanometri (è mostrata solo la metà del guscio). Credito:Dr Chester L. Drum
Un team della NUS Yong Loo Lin School of Medicine (NUS Medicine) ha inventato un modo fondamentalmente nuovo di ripiegare e proteggere le proteine ricombinanti. Provenienti dal campo in rapida espansione della biologia sintetica, questa tecnologia proteina-in-proteina può migliorare la resa proteica funzionale di 100 volte e proteggere le proteine ricombinanti dal calore, prodotti chimici aggressivi e proteolisi.
L'espressione e la stabilizzazione delle proteine ricombinanti è la pietra angolare delle industrie biologiche e farmaceutiche. I costi e la complessità associati alla produzione di proteine ricombinanti difficili da piegare su scala industriale sono un fattore limitante significativo per il loro utilizzo nelle applicazioni cliniche e industriali.
Lo studio condotto dal dottor Chester Drum, Ricercatore presso i Dipartimenti di Medicina e Biochimica, NUS Medicine è stato pubblicato sulla rivista Comunicazioni sulla natura il 13 novembre 2017. Il dottor Drum e colleghi hanno progettato un exoshell di 12 nanometri di diametro e lo hanno avvolto attorno a una proteina di interesse (POI). Hanno dimostrato per la prima volta che questa tecnologia può essere utilizzata per piegare e proteggere una varietà di proteine all'interno di cavità ingegnerizzate inferiori a 1:10, 000 la larghezza di un capello umano.
I ricercatori hanno sviluppato questa tecnologia proteina all'interno di una proteina con l'aiuto di Archeoglobus fulgidus, un batterio resistente che si trova naturalmente nelle bocche idrotermali. Questi batteri ipertermofili hanno evoluto soluzioni uniche per il ripiegamento e la stabilizzazione delle proteine a causa degli ambienti estremi in cui vivono.
In particolare, i ricercatori hanno utilizzato un trasportatore di ferro, Proteina a 24 subunità in A. fulgidus chiamata ferritina, la cui funzione naturale è quella di immagazzinare e trasportare il ferro nel sangue. La ferritina di A. fulgidus ha due proprietà uniche:primo, quattro minuscoli pori nel suo guscio forniscono alle piccole molecole l'accesso nella cavità; secondo, a differenza della ferritina umana che è stabile a basse concentrazioni di sale, la ferritina ingegnerizzata di A. fulgidus si dissocia a basse concentrazioni di sale, consentendo il rilascio del contenuto della cavità con un semplice interruttore di pH da 8,0 a 5,8. Una volta dissociato, il POI può essere rilasciato enzimaticamente.
Per dimostrare l'ampia versatilità della loro tecnologia, i ricercatori hanno testato la loro tecnologia exoshell fondendo una delle 24 subunità di ferritina attorno a tre POI con proprietà diverse:proteina fluorescente verde, perossidasi di rafano (HRP) e luciferasi di Renilla.
Non solo l'exoshell ha contribuito ad aumentare i rendimenti di tutti e tre i POI, i ricercatori sono stati anche in grado di fornire cofattori eme e calcio, oltre alle condizioni ossidanti, per garantire che POI complessi come la proteina HRP possano ripiegarsi e funzionare correttamente.
Oltre ad aiutare a piegare correttamente i POI, gli exoshell erano anche protettivi contro un'ampia gamma di denaturanti, inclusa tripsina ad alta concentrazione; solventi organici come acetonitrile e metanolo; e denaturanti come l'urea, acido cloridrico guanidina, e calore.
"Ipotizziamo che il significativo aumento della resa proteica funzionale possa essere dovuto alla complementazione tra le proteine caricate negativamente e la superficie interna dell'exoshell caricata positivamente. I nostri risultati evidenziano il potenziale dell'utilizzo di gusci di dimensioni nanometriche altamente ingegnerizzati come strumento di biologia sintetica per influenzare la produzione e la stabilità delle proteine ricombinanti, " disse il dottor Drum, che è anche cardiologo consulente presso il National University Hospital e direttore del Clinical Trial Innovation Lab presso TLGM, UNA STELLA.
Reclutato alla National University of Singapore nel 2011, da allora ha ricevuto finanziamenti dalla Singapore MIT Alliance for Research and Technology, Consiglio nazionale delle ricerche mediche, Consiglio per la ricerca biomedica, Medicina A*STAR e NUS.
L'attuale ricerca del dottor Drum colma il divario tra la biochimica di base e l'assistenza clinica. Attualmente è il principale investigatore su un multi-istituzionale, 3, Studio osservazionale di 000 persone a Singapore che studia come il metabolismo personalizzato dei farmaci influenzi la risposta ai farmaci.