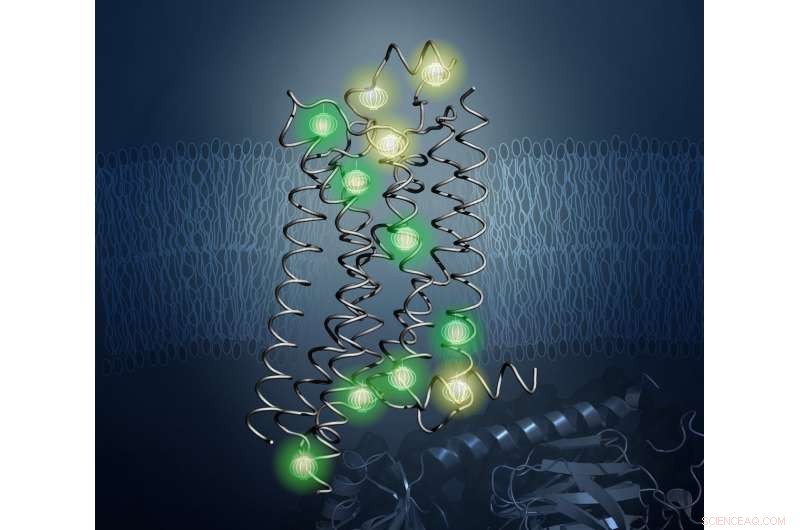
Le sonde (mostrate incandescenti qui) hanno rivelato l'architettura interna della proteina A2aAR nel nuovo studio. Credito:Kurt Wuthrich e Matthew Eddy, L'Istituto di ricerca Scripps
Gli scienziati dello Scripps Research Institute (TSRI) hanno scrutato in profondità nel cuore di una proteina chiave utilizzata nella progettazione di farmaci e hanno scoperto caratteristiche strutturali dinamiche che possono portare a nuovi modi per colpire le malattie. La proteina, chiamato l'A 2A recettore dell'adenosina (A 2a AR), è un membro della famiglia dei recettori accoppiati a proteine G (GPCR), che sono gli obiettivi di circa il 40% di tutti i prodotti farmaceutici approvati.
Il nuovo, immagine più dettagliata di A 2a Il meccanismo di segnalazione di AR rivela parti chiave del suo funzionamento interno, compreso un amminoacido che agisce come un "interruttore a levetta" per controllare la segnalazione attraverso la membrana cellulare.
"Questa conoscenza di base è potenzialmente utile per migliorare la progettazione dei farmaci, "dice il premio Nobel Kurt Wthrich, dottorato di ricerca, il Cecil H. e Ida M. Green Professor di Biologia Strutturale al TSRI e autore senior dello studio.
I risultati sono stati pubblicati oggi sulla rivista Cellula .
La tecnica di imaging rivela come le proteine cambiano forma
Tutte le cellule umane contengono A 2a AR e altri GPCR incorporati nella loro membrana plasmatica. Più di 800 GPCR sono stati scoperti nel corpo umano, e ciascuno ha un ruolo nella regolazione di una funzione corporea. Per esempio, UN 2a L'AR regola il flusso sanguigno e l'infiammazione e media gli effetti della caffeina. UN 2a L'AR è anche un obiettivo convalidato per il trattamento del morbo di Parkinson e un obiettivo relativamente nuovo per il targeting dei tumori.
"I GPCR fanno praticamente tutto ciò che puoi immaginare, " dice Wthrich. "Ma per molto tempo, la progettazione di farmaci veniva eseguita senza sapere come apparivano i GPCR".
Per il nuovo studio, i ricercatori miravano a comprendere meglio la relazione tra A 2a Funzione AR e cambiamenti dinamici nella sua struttura per aiutare a informare la progettazione di farmaci.
La ricerca si è basata su studi precedenti in cui gli scienziati hanno utilizzato una tecnica di imaging chiamata cristallografia a raggi X per determinare A 2a La struttura tridimensionale di AR. Le immagini hanno mostrato che A 2a AR si presenta come una catena che attraversa la membrana cellulare e ha un'apertura sul lato rivolto verso l'esterno della cellula. La regione della struttura GPCR che sporge dalla membrana interagisce con farmaci e altre molecole per segnalare alle proteine partner all'interno della cellula.
Sebbene le strutture cristalline fornissero uno schema chiave della forma del recettore negli stati inattivi e attivi, non potevano mostrare movimento e cambiamenti nella struttura quando A 2a AR incontra nuovi partner vincolanti, come i candidati farmaceutici. In breve, i ricercatori nel nuovo studio avevano bisogno di indagare sul perché A 2a L'AR funziona come funziona.
Risolvere questo problema, i ricercatori hanno utilizzato una tecnica chiamata spettroscopia di risonanza magnetica nucleare (NMR), che crea forti campi magnetici per localizzare le posizioni delle sonde in un campione. Wthrich è un leader di fama mondiale nel campo dell'NMR e ha vinto il Premio Nobel per la Chimica nel 2002 per il lavoro pionieristico nell'NMR per studiare le strutture delle molecole biologiche. Con RMN, gli scienziati possono determinare le strutture delle proteine e studiarne le proprietà dinamiche in soluzione a temperature fisiologiche, il modo in cui esistono nel corpo umano.
Nel lavoro guidato da Matthew Eddy di TSRI, dottorato di ricerca, primo autore del nuovo studio, i ricercatori hanno usato la risonanza magnetica nucleare per osservare A 2a AR in molte diverse conformazioni, facendo luce su come cambia forma sulla superficie delle cellule umane in risposta ai trattamenti farmacologici.
È importante sottolineare che L'NMR ha permesso al team di visualizzare i cambiamenti nell'architettura interna di A 2a AR. Questo li ha portati oltre i precedenti studi NMR con soluzioni, che si è concentrato sull'osservazione tecnicamente meno impegnativa di sonde osservabili NMR attaccate a parti flessibili di GPCR, per lo più localizzati in corrispondenza o in prossimità della superficie del recettore. L'approccio nel nuovo studio ha permesso ai ricercatori di seguire gli effetti del legame dei farmaci sulla superficie extracellulare sui cambiamenti nella struttura e nella dinamica delle proteine sulla superficie intracellulare, la base strutturale del trasferimento del segnale, attraverso il cuore del GPCR.
Era come se i ricercatori avessero visto un'auto, e con NMR, potevano finalmente ispezionarne il motore.
Ripensare al modo in cui progettiamo i farmaci
Due dettagli in A 2a La struttura di AR ha fornito ai ricercatori informazioni su come i futuri farmaci potrebbero manipolare il recettore. Una scoperta chiave è stata che la sostituzione di un particolare amminoacido nel centro del recettore ha distrutto la capacità del recettore di inviare segnali alla cellula.
"Con questa constatazione, possiamo dire 'A-ha! È questo cambiamento nella struttura che uccide l'attività di segnalazione.' Forse possiamo cambiare un farmaco per superare questo limite, "dice Wthrich.
I ricercatori hanno anche rivelato l'attività di un "interruttore a levetta" in A 2a AR. Precedenti studi hanno suggerito che uno degli amminoacidi triptofano in A 2a AR si alza e si abbassa di concerto con A 2a L'attività di AR. Con RMN, gli scienziati hanno osservato direttamente questo triptofano unico mentre cambiava orientamento in risposta a diversi farmaci. I chimici potrebbero potenzialmente modificare i farmaci per manipolare questo interruttore e controllare l'A 2a segnalazione AR.
I ricercatori sottolineano che questo nuovo studio è potenzialmente rilevante per gran parte della grande famiglia dei GPCR. Infatti, structural details from this study could apply to more than 600 "class A" GPCRs in our bodies.
In addition to Wthrich and Eddy, authors of the study, "Allosteric Coupling of Drug Binding and Intracellular Signaling in the A 2a Adenosine Receptor, " were Tatiana Didenko and Pawel Stanczak of The Scripps Research Institute; Reto Horst of The Scripps Research Institute and Pfizer Worldwide Research and Development; Zhan-Guo Gao and Kenneth A. Jacobson of the National Institutes of Health; and Ming-Yue Lee, Kyle M. McClary, Gye Won Han, Martin Audet, Kate L. White and Raymond C. Stevens of the University of Southern California.