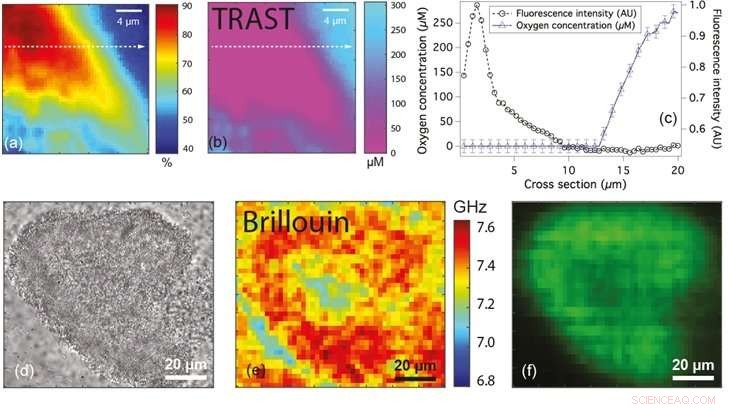
Le figure (a) e (b) mostrano rispettivamente la mappa della fluorescenza e della concentrazione di ossigeno di una microcolonia di batteri. La figura (c) mostra il profilo della linea di fluorescenza (cerchi) e concentrazione di ossigeno (triangoli) lungo la linea tratteggiata in (a) e (b). Figure (d), (e) e (f) sono i microscopici a campo ampio, Brillouin e immagini di fluorescenza rispettivamente di una microcolonia di batteri che mostrano differenze nello spostamento di frequenza, che può essere utilizzato per classificare lo stato del biofilm. Credito:Università Nazionale di Singapore
Scienziati NUS, insieme ai ricercatori della Nanyang Technological University (NTU) e dell'Imperial College London (ICL), hanno sviluppato tecniche biofisiche non invasive per quantificare la concentrazione di ossigeno e le proprietà micromeccaniche nei biofilm batterici e comprenderne le risposte in tempo reale ai cambiamenti ambientali.
Comunità di batteri, fungo, i protozoi o le alghe che aderiscono l'uno all'altro o alle superfici sono noti come biofilm. I biofilm sono caratterizzati da una varietà di proprietà che non si trovano tipicamente negli organismi viventi isolati. Una delle proprietà emergenti dei biofilm rilevanti nel contesto della salute umana è la loro maggiore tolleranza a disinfettanti e antibiotici. Mentre alcuni biofilm sono utili (ad esempio quelli coinvolti nel trattamento delle acque reflue e nel biorisanamento), molti altri sono dannosi (ad esempio quelli coinvolti in infezioni e corrosione). Come ogni organismo vivente, i biofilm si adattano e rispondono continuamente a una varietà di stress ambientali, come cambiamenti nella disponibilità di nutrienti o ossigeno.
L'ossigeno svolge un ruolo essenziale nella generazione di energia per il mantenimento e la crescita delle cellule. La quantificazione della quantità di ossigeno è necessaria per studiarne gli effetti durante le varie fasi di crescita del biofilm. Gli strumenti attuali per misurare i livelli di ossigeno nei biofilm consumano essi stessi ossigeno (portando a risultati meno accurati) o possono ottenere misurazioni accurate solo dalla superficie ma non all'interno dei biofilm.
Per superare questi limiti, Prof Thorsten WOHLAND dei Dipartimenti di Scienze Biologiche e Chimica, NUS insieme al Prof Yehuda COHEN e al Prof Scott RICE di NTU hanno adattato una tecnica non invasiva chiamata Transient State Imaging (TRAST) e l'hanno applicata per quantificare i livelli di ossigeno nei biofilm batterici. Ciò ha portato all'identificazione di zone carenti di ossigeno all'interno delle colonie microscopiche di P. aeruginosa. TRAST è una tecnica di imaging basata sulla luminescenza. Si basa sul fatto che alcuni fluorofori (un tipo di composto chimico fluorescente) occupano due stati diversi, uno che emette fluorescenza e l'altro uno stato oscuro non fluorescente. La frazione di fluorofori allo stato oscuro dipende dalla frequenza con cui i fluorofori sono eccitati e se viene loro concesso abbastanza tempo per tornare dagli stati oscuri agli stati fluorescenti. Modificando lo schema di illuminazione in modi definiti, la quantità di fluorofori attraverso il biofilm (allo stato scuro) può essere misurata facilmente. Le misurazioni dipendono solo dalla frazione di fluorofori allo stato scuro, il che significa che l'accuratezza non è influenzata anche se alcune regioni del biofilm hanno una maggiore concentrazione di fluorofori. Poiché l'ossigeno sopprime l'occupazione degli stati oscuri, e quindi abbassa i fluorofori che risiedono nello stato oscuro, TRAST può essere utilizzato per quantificare le concentrazioni di ossigeno.
Questo strumento ha potenziali implicazioni in microbiologia per differenziare le zone ricche di ossigeno da quelle carenti di ossigeno, che sono tipicamente occupati da batteri aerobi e anaerobi rispettivamente in un biofilm multispecie. Questa differenziazione è importante nella diagnostica perché aiuterà nell'identificazione del tipo di batteri nel sito di infezione.
Lo stesso team di ricerca, in collaborazione con il prof. Peter TÖRÖK dell'ICL, ha anche sviluppato una tecnica che utilizza la microscopia Brillouin per sondare le proprietà meccaniche dei biofilm a livello di scala micrometrica. La microscopia Brillouin consente la quantificazione della compressibilità misurando lo spostamento della frequenza della luce incidente in seguito all'interazione con il biofilm. La comprimibilità di un materiale è la quantità di sollecitazione necessaria per provocare una variazione del volume di un materiale. La comprimibilità di un materiale può essere interpretata in termini di rigidità del materiale. I materiali che mostrano spostamenti di frequenza maggiori sono più rigidi di quelli con spostamenti di frequenza minori. Questa tecnica, che è "senza etichetta" (cioè non utilizza alcuna molecola estranea), può essere potenzialmente utilizzato per comprendere le proprietà micromeccaniche di biofilm complessi.
Il professor Wohland ha detto, "I biofilm possono avere effetti distruttivi, per esempio nell'infezione della ferita o nella degradazione dei materiali. Però, possono anche essere sfruttati per la produzione di materiali biologici o altri processi. Entrambe le applicazioni richiedono una buona comprensione delle proprietà fisiche e fisiologiche dei biofilm. Perciò, nuovi strumenti, man mano che il nostro team si è sviluppato, sono necessari per caratterizzare meglio i biofilm nel loro ambiente naturale".