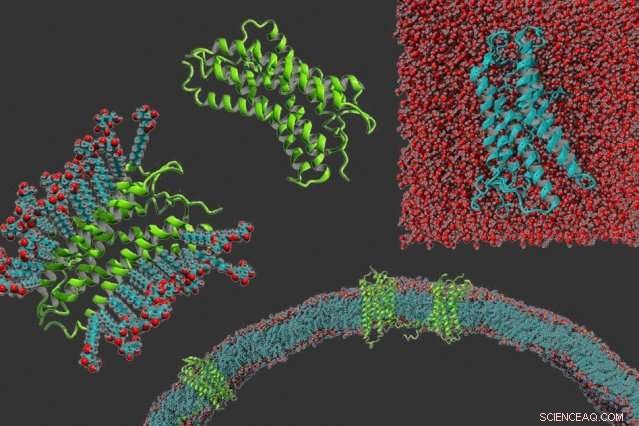
In senso orario da sinistra:un recettore accoppiato alla proteina g nel detersivo, la proteina da sola, un recettore accoppiato a proteine g che è stato reso solubile in acqua, e recettori accoppiati a proteine g incorporati in una membrana. Credito:Michael Skuhersky
Circa il 30% delle proteine codificate dal genoma umano sono proteine di membrana, proteine che attraversano la membrana cellulare in modo da facilitare la comunicazione tra le cellule e il loro ambiente. Queste molecole sono fondamentali per l'apprendimento, vedendo, e percependo gli odori, tra tante altre funzioni.
Nonostante la prevalenza di queste proteine, gli scienziati hanno avuto difficoltà a studiare le loro strutture e funzioni perché le porzioni legate alla membrana sono molto idrofobe, quindi non possono essere sciolti in acqua. Questo rende molto più difficile fare analisi strutturali, come la cristallografia a raggi X.
In un anticipo che potrebbe facilitare l'esecuzione di questo tipo di studio strutturale, I ricercatori del MIT hanno sviluppato un modo per rendere queste proteine idrosolubili scambiando alcuni dei loro amminoacidi idrofobici con quelli idrofili. La tecnica si basa su un codice molto più semplice dei metodi precedentemente sviluppati per rendere solubili queste proteine, che si basano su algoritmi informatici che devono essere adattati a ciascuna proteina caso per caso.
"Se non c'è una regola da seguire, è difficile per le persone capire come farlo, "dice Shuguang Zhang, uno dei principali ricercatori nel Center for Bits and Atoms del MIT Media Lab. "Lo strumento deve essere semplice, qualcosa che chiunque può usare, non una sofisticata simulazione al computer che solo poche persone sanno usare."
Zhang è l'autore senior dello studio, che appare in Atti dell'Accademia Nazionale delle Scienze la settimana del 27 agosto. Altri autori del MIT sono l'ex visiting professor Fei Tao, postdottorato Rui Qing, ex professore in visita Hongzhi Tang, studente laureato Michael Skuhersky, ex studentessa Karolina Corin '03, SM '05, dottorato di ricerca '11, l'ex postdoc Lotta Tegler, studente laureato Asmamaw Wassie, e l'ex studente universitario Brook Wassie '14.
Un semplice codice
Dei circa 8, 000 proteine di membrana note presenti nelle cellule umane, gli scienziati hanno scoperto strutture per circa 50. Sono ampiamente considerate molto difficili da lavorare perché una volta estratte dalla membrana cellulare, mantengono la loro struttura solo se sospesi in un detersivo, che imita l'ambiente idrofobo della membrana cellulare. Questi detersivi sono costosi, e non esiste un detersivo universale che funzioni per tutte le proteine di membrana.
Zhang ha iniziato a lavorare su un nuovo modo per affrontare questo problema nel 2010, ispirato dal compianto Alexander Rich, un professore di biologia del MIT. Rich ha posto la domanda se le strutture proteiche chiamate alfa eliche, che costituiscono la maggior parte della porzione di proteine incorporata nella membrana, potrebbe passare da idrofobo a idrofilo. Zhang iniziò immediatamente a elaborare possibili soluzioni, ma il problema si è rivelato difficile. Negli ultimi otto anni, ha avuto diversi studenti e ricercatori in visita che lo hanno aiutato a lavorare sulla sua idea, più recentemente Qing, che ha raggiunto il successo.
L'idea chiave che ha permesso a Zhang di sviluppare il codice è il fatto che una manciata di amminoacidi idrofobici ha strutture molto simili ad alcuni amminoacidi idrofili. Queste somiglianze hanno permesso a Zhang di elaborare un codice in cui la leucina viene convertita in glutammina, isoleucina e valina vengono convertite in treonina, e la fenilalanina viene convertita in tirosina.
Un altro fattore importante è che nessuno di questi amminoacidi è carico, quindi scambiarli sembra avere un effetto minimo sulla struttura proteica complessiva. Infatti, isoleucina e treonina sono così simili che i ribosomi, le strutture cellulari che assemblano le proteine, di tanto in tanto inserisci quello sbagliato, circa una volta ogni 200-400 occorrenze.

Il postdoc Rui Qing e il principale ricercatore scienziato Shuguang Zhang hanno guidato lo sforzo per trovare un modo semplice per rendere solubili in acqua le proteine legate alla membrana. Credito:Jun Ni
I ricercatori chiamano il loro codice il codice QTY, dopo le tre lettere che rappresentano la glutammina, treonina, e tirosina, rispettivamente.
Nei loro primi sforzi per implementare questo codice, i ricercatori hanno sostituito solo una piccola frazione degli amminoacidi idrofobici incorporati nella membrana, ma le proteine risultanti avevano ancora bisogno di un po' di detersivo per dissolversi. Hanno aumentato il tasso di sostituzione a circa il 50 percento, ma le proteine non erano ancora completamente solubili in acqua, così hanno sostituito tutte le istanze di glutammina, isoleucina, valina, e fenilalanina incorporata nelle membrane. Questa volta, hanno raggiunto il successo.
"Solo quando sostituiamo tutti i residui idrofobici nelle regioni transmembrana siamo in grado di ottenere proteine stabili e completamente prive di detersivo in un sistema acquoso, " dice Qing.
Somiglianze strutturali
In questo studio, i ricercatori hanno dimostrato la loro tecnica su quattro proteine che appartengono a una classe di proteine note come recettori accoppiati a proteine G. Queste proteine aiutano le cellule a riconoscere le molecole, come gli ormoni, o molecole immunitarie, chiamate chemochine, e innescare una risposta appropriata all'interno della cellula.
Joel Sussman, professore di biologia strutturale al Weizmann Institute of Science, ha descritto il nuovo metodo come "incredibilmente semplice ed elegante".
"Sebbene diversi scienziati abbiano cercato di trovare un modo per 'solubilizzare' i recettori accoppiati a proteine G e altre proteine integrali di membrana, fino ad ora i loro metodi non sono stati di uso generale e spesso implicavano metodi computazionali molto complessi che non sarebbero ampiamente applicabili, "dice Susman, che non è stato coinvolto nella ricerca.
I ricercatori stanno ancora lavorando per ottenere le strutture precise di queste proteine usando la cristallografia a raggi X o la risonanza magnetica nucleare (NMR), ma hanno eseguito alcuni esperimenti che suggeriscono che le strutture sono simili. In uno, hanno mostrato che le proteine idrosolubili si denaturano quasi alla stessa temperatura delle versioni originali delle proteine. Hanno anche dimostrato che le proteine modificate si legano alle stesse molecole bersaglio a cui si legano le proteine originali, anche se non così forte.
Essere in grado di sintetizzare versioni idrosolubili di queste proteine potrebbe consentire nuove applicazioni, come sensori in grado di rilevare gli inquinanti ambientali, dicono i ricercatori.
Un'altra possibilità è progettare versioni idrosolubili delle proteine che si legano a molecole normalmente espresse dalle cellule cancerose, che potrebbe essere utilizzato per diagnosticare tumori o identificare cellule tumorali metastatiche in campioni di sangue, dice Zhang. I ricercatori potrebbero anche creare molecole idrosolubili in cui un recettore legato alla membrana a cui i virus si legano normalmente è attaccato a una parte di un anticorpo. Se queste "terapie esche" fossero iniettate nel corpo, i virus si legherebbero ai recettori e quindi sarebbero eliminati dal sistema immunitario, che verrebbe attivato dalla porzione anticorpale.