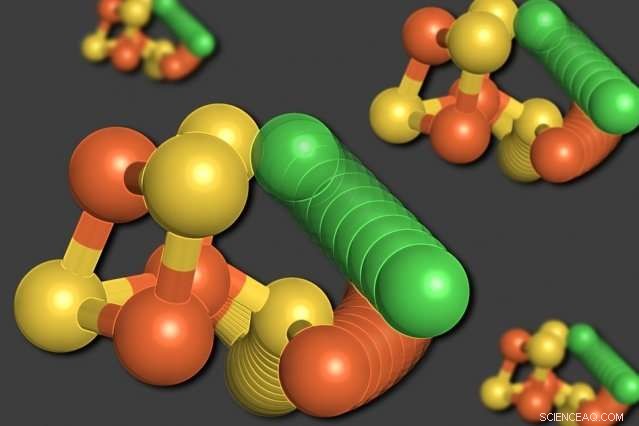
I ricercatori del MIT hanno dimostrato che alcuni degli atomi di un enzima chiamato monossido di carbonio deidrogenasi possono riorganizzarsi quando i livelli di ossigeno sono bassi. Un atomo di nichel (verde) lascia la struttura cubica, spostamento di un atomo di ferro (arancione). Anche un atomo di zolfo (giallo) esce dal cubo. Credito:Elizabeth Wittenborn
Molti microbi hanno un enzima in grado di convertire l'anidride carbonica in monossido di carbonio. Questa reazione è fondamentale per la costruzione di composti di carbonio e la generazione di energia, in particolare per i batteri che vivono in ambienti privi di ossigeno.
Questo enzima è anche di grande interesse per i ricercatori che vogliono trovare nuovi modi per rimuovere i gas serra dall'atmosfera e trasformarli in utili composti contenenti carbonio. Gli attuali metodi industriali per trasformare l'anidride carbonica sono molto energivori.
"Ci sono processi industriali che fanno queste reazioni ad alte temperature e alte pressioni, e poi c'è questo enzima che può fare la stessa cosa a temperatura ambiente, "dice Catherine Drennan, un professore di chimica e biologia del MIT e un investigatore dell'Howard Hughes Medical Institute. "Per molto tempo, le persone sono state interessate a capire come la natura esegue questa chimica impegnativa con questo assemblaggio di metalli".
Drennan e i suoi colleghi del MIT, Università Brandeis, e l'Università di Aix-Marseille in Francia hanno ora scoperto un aspetto unico della struttura del "cluster C", la raccolta di atomi di metallo e zolfo che costituisce il cuore dell'enzima monossido di carbonio deidrogenasi (CODH). Invece di formare un'impalcatura rigida, come ci si aspettava, il cluster può effettivamente modificare la sua configurazione.
"Non era quello che ci aspettavamo di vedere, "dice Elizabeth Wittenborn, un recente dottorato di ricerca del MIT. destinatario e l'autore principale dello studio, che appare nel numero del 2 ottobre della rivista eLife .
Una ruota di carro molecolare
I cluster contenenti metalli come il C-cluster eseguono molte altre reazioni critiche nei microbi, compresa la scissione del gas azoto, difficilmente replicabili industrialmente.
Drennan ha iniziato a studiare la struttura della monossido di carbonio deidrogenasi e dell'ammasso C circa 20 anni fa, subito dopo aver avviato il suo laboratorio al MIT. Lei e un altro gruppo di ricerca hanno trovato una struttura per l'enzima usando la cristallografia a raggi X, ma le strutture non erano esattamente le stesse. Le differenze sono state alla fine risolte e si pensava che la struttura del CODH fosse ben consolidata.
Wittenborn ha ripreso il progetto alcuni anni fa, nella speranza di capire perché l'enzima è così sensibile all'inattivazione da parte dell'ossigeno e determinare come viene messo insieme il gruppo C.
Con grande sorpresa dei ricercatori, la loro analisi ha rivelato due strutture distinte per il C-cluster. La prima era una disposizione che si aspettavano di vedere:un cubo composto da quattro atomi di zolfo, tre atomi di ferro, e un atomo di nichel, con un quarto atomo di ferro connesso al cubo.
Nella seconda struttura, però, l'atomo di nichel viene rimosso dalla struttura cubica e prende il posto del quarto atomo di ferro. L'atomo di ferro spostato si lega ad un amminoacido vicino, cisteina, che lo tiene nella sua nuova sede. Anche uno degli atomi di zolfo esce dal cubo. Tutti questi movimenti sembrano avvenire all'unisono, in un movimento che i ricercatori descrivono come una "ruota molecolare".
"Lo zolfo, il ferro, e il nichel si sposta in nuove posizioni, "Drennan dice. "Siamo rimasti davvero scioccati. Pensavamo di aver capito questo enzima, ma abbiamo scoperto che sta facendo questo movimento incredibilmente drammatico che non ci saremmo mai aspettati. Poi abbiamo fornito ulteriori prove del fatto che questo è in realtà qualcosa di rilevante e importante:non è solo una cosa casuale, ma fa parte del design di questo cluster".
I ricercatori ritengono che questo movimento, che si verifica all'esposizione all'ossigeno, aiuta a proteggere il grappolo dalla caduta totale e irreversibile in risposta all'ossigeno.
"Sembra che questa sia una rete di sicurezza, permettendo ai metalli di essere spostati in luoghi dove sono più sicuri sulla proteina, "Drennan dice.
Douglas Rees, un professore di chimica al Caltech, ha descritto il documento come "un bellissimo studio di un affascinante processo di conversione dei cluster".
"Questi ammassi hanno caratteristiche simili a minerali e si potrebbe pensare che sarebbero "stabili come una roccia, '" dice Rees, che non è stato coinvolto nella ricerca. "Anziché, i cluster possono essere dinamici, che conferisce loro proprietà che sono fondamentali per la loro funzione in un ambiente biologico."
Non un'impalcatura rigida
Questo è il più grande spostamento di metalli che sia mai stato visto in un cluster enzimatico, ma riarrangiamenti su piccola scala sono stati osservati in alcuni altri, compreso un cluster metallico trovato nell'enzima nitrogenasi, che converte l'azoto gassoso in ammoniaca.
"Nel passato, la gente pensava a questi grappoli come a delle impalcature rigide, ma solo negli ultimi anni stanno emergendo sempre più prove che non sono veramente rigidi, "Drennan dice.
I ricercatori stanno ora cercando di capire come le cellule assemblano questi cluster. Ulteriori informazioni su come funzionano questi cluster, come sono assemblati, e il modo in cui sono influenzati dall'ossigeno potrebbe aiutare gli scienziati che stanno cercando di copiare la loro azione per uso industriale, dice Drennan. C'è un grande interesse nel trovare modi per combattere l'accumulo di gas serra attraverso, Per esempio, convertire l'anidride carbonica in monossido di carbonio e poi in acetato, che può essere utilizzato come elemento costitutivo per molti tipi di composti contenenti carbonio utili.
"È più complicato di quanto la gente pensasse. Se lo capiamo, allora abbiamo molte più possibilità di imitare davvero il sistema biologico, "Drennan dice.
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.