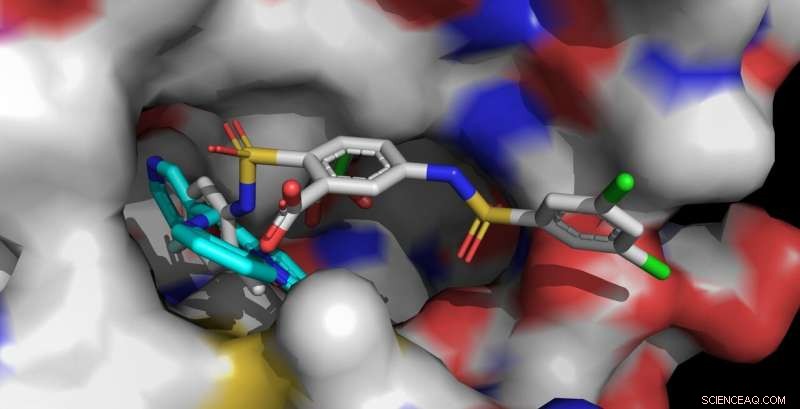
Gli attivatori Sirt6 UBCS039 (ciano, anteriore sinistro) e MDL-801 (multicolore, anteriore destro) sono ancorati nella stessa tasca per rilegatura di Sirt6. La molecola MDL-801 più lunga contatta anche le aree superficiali adiacenti e interagisce più fortemente con Sirt6. Credito:Clemens Steegborn
Nella ricerca di modi per combattere efficacemente le malattie umane legate all'età, l'enzima sirtuina 6 (Sirt6) è recentemente diventato un fulcro della ricerca biochimica. Un'attivazione mirata di Sirt6 potrebbe prevenire o mitigare tali malattie, per esempio alcuni tipi di cancro. In un articolo per il giornale Natura chimica biologia , i biochimici dell'Università di Bayreuth hanno ora dimostrato come la piccola molecola MDL-801 si leghi all'enzima Sirt6 e ne influenzi l'attività. Questi risultati stanno per aiutare lo sviluppo di nuovi farmaci.
Il corpo umano contiene sette diverse sirtuine, denominato Sirt1 a Sirt7. Questi enzimi svolgono un ruolo essenziale nella regolazione del metabolismo e delle reazioni allo stress. Negli ultimi anni, il gruppo di ricerca guidato dal Prof. Dr. Clemens Steegborn dell'Università di Bayreuth ha mostrato in diversi articoli di ricerca come Sirt6 può essere attivato da piccole molecole. Con il loro studio, ora pubblicato in Natura chimica biologia , Steegborn e il suo assistente di ricerca, il dottor Weijie, hanno seguito questi risultati. Hanno scoperto che la molecola MDL-801 interagisce con Sirt6 utilizzando una caratteristica strutturale unica di questo enzima:una tasca di legame insolitamente ampia che è facilmente accessibile dall'esterno ed è normalmente coinvolta nell'interazione con le proteine del substrato. Questa cavità molecolare continua in un canale aperto che conduce al centro catalitico di Sirt6. È in questo canale, caratteristica di Sirt6, che MDL-801 si ancora quando attiva l'enzima. Principalmente attraverso studi di attività e analisi della struttura a raggi X, Steegborn e Lei sono stati in grado di identificare sia il sito di legame che i processi molecolari coinvolti nell'attivazione di Sirt6 da parte di MDL-801.
Come i biochimici di Bayreuth hanno già dimostrato in studi precedenti, le sostanze attive UBCS039, quercetina, e fluvastatina sono anche in grado di attivare Sirt6. Fare così, usano lo stesso canale aperto in cui si aggancia l'MDL-801. Questa cavità allungata è anche chiamata canale acilico. Non appena Sirt6 è in uno stato attivato, scinde i gruppi acilici dalle proteine. In tal modo, influenza, tra l'altro, la sintesi di proteine controllate da geni. I risultati sull'attivazione di Sirt6 offrono quindi preziosi indizi per lo sviluppo di sostanze attive che potrebbero contrastare le malattie legate all'invecchiamento, ad esempio lo sviluppo di tumori.
"Tutte le piccole molecole per le quali siamo stati finora in grado di dimostrare un effetto attivante su Sirt6 utilizzano il canale acilico per legarsi alla Sirtuina 6. E sebbene le loro strutture chimiche siano molto diverse, lo fanno in modi molto simili. Questo ci apre l'opportunità di usare i dettagli delle loro rispettive interazioni per mettere a punto i composti attivanti. Tali farmaci sarebbero quindi in grado di regolare Sirt6 in modo specifico. In tal modo, potrebbero essere utilizzati in modo mirato per prevenire o curare malattie associate al processo di invecchiamento, "dice Steegborn.
Con il loro nuovo studio, Steegborn e You hanno confutato una dichiarazione chiave che un gruppo di ricerca a Shanghai ha pubblicato in Natura chimica biologia nel 2018. In questo articolo, MDL-801 è stato descritto come un nuovo attivatore Sirt6. Una struttura cristallografica a raggi X è stata utilizzata per mostrare che MDL-801 si lega a una sezione molecolare diversa di Sirt6 rispetto ad altri attivatori. "Questa struttura, risultato di un'errata interpretazione dei dati sperimentali, ha fuorviato numerosi gruppi di ricerca sin dalla sua pubblicazione. Il nostro studio corregge questo errore e permette così di lavorare in modo efficiente su attivatori migliorati, "dice Steegborn.