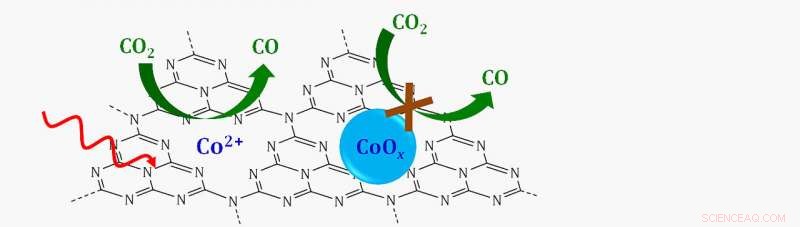
Schema di un catalizzatore a sito singolo in cui singoli ioni cobalto (CO 2 +) supportato su uno strato di azoto carbonioso grafitico (C3N4) riduce l'anidride carbonica (CO 2 ) al monossido di carbonio (CO) in presenza di luce visibile (freccia rossa ondulata). Se il cobalto fosse legato all'ossigeno per formare un ossido di cobalto (CoOx), la reazione non sarebbe proseguita. Credito:Brookhaven National Laboratory
Un team di scienziati ha scoperto un singolo sito, catalizzatore attivato dalla luce visibile che converte l'anidride carbonica (CO 2 ) in molecole "mattoni" che potrebbero essere utilizzate per creare sostanze chimiche utili. La scoperta apre la possibilità di utilizzare la luce solare per trasformare un gas serra in idrocarburi.
Gli scienziati hanno utilizzato la National Synchrotron Light Source II, una struttura per gli utenti dell'Ufficio delle scienze del Dipartimento dell'energia degli Stati Uniti (DOE) presso il Brookhaven National Laboratory, per scoprire i dettagli della reazione efficiente, che ha utilizzato un singolo ione di cobalto per aiutare ad abbassare la barriera energetica per abbattere la CO 2 . Il team descrive questo catalizzatore a sito singolo in un documento appena pubblicato nel Giornale della Società Chimica Americana .
Conversione di CO 2 in parti più semplici, monossido di carbonio (CO) e ossigeno, ha preziose applicazioni nel mondo reale. "Rompere CO 2 , possiamo prendere due piccioni con una fava:rimuovere la CO2 dall'atmosfera e creare mattoni per produrre carburante, " disse Anatoly Frenkel, un chimico con un appuntamento congiunto al Brookhaven Lab e alla Stony Brook University. Frenkel ha guidato lo sforzo per comprendere l'attività del catalizzatore, che è stato fatto da Gonghu Li, un chimico fisico presso l'Università del New Hampshire.
"Ora abbiamo le prove che abbiamo realizzato un catalizzatore a sito singolo. Nessun lavoro precedente ha riportato CO . solare 2 riduzione utilizzando un singolo ione, " disse Frenkel.
Rompere i legami che trattengono la CO 2 insieme richiedono molta energia e molto tempo. Così, Li ha deciso di sviluppare un catalizzatore per abbassare la barriera energetica e accelerare il processo.
"La domanda è, tra diversi possibili catalizzatori, quali sono efficienti e pratici da implementare nell'industria?", ha affermato Frenkel.
Un ingrediente chiave necessario per rompere i legami della CO 2 è una fornitura di elettroni. Questi elettroni possono essere generati quando un materiale noto come semiconduttore viene attivato dall'energia sotto forma di luce. La luce "scaccia" gli elettroni, per così dire, rendendoli disponibili al catalizzatore per le reazioni chimiche. La luce del sole potrebbe essere una fonte naturale di tale luce. Ma molti semiconduttori possono essere attivati solo dalla luce ultravioletta, che costituisce meno del cinque per cento dello spettro solare.
"La sfida è trovare un altro materiale semiconduttore in cui l'energia della luce solare naturale si abbini perfettamente per espellere gli elettroni, " ha detto Frenkel.
Gli scienziati avevano anche bisogno che il semiconduttore fosse legato a un catalizzatore realizzato con materiali che si potevano trovare in abbondanza in natura, piuttosto che raro, metalli costosi come il platino. E volevano che il catalizzatore fosse abbastanza selettivo da guidare solo la reazione che converte la CO 2 a CO.
"Non vogliamo che gli elettroni vengano utilizzati per reazioni diverse dalla riduzione della CO 2 , " ha detto Frenkel.
Ioni di cobalto legati al nitruro di carbonio grafitico (C3N4), un semiconduttore in carbonio, azoto, e atomi di idrogeno, ha spuntato tutte le caselle per questi requisiti.
"C'è stato un notevole interesse nell'uso del C3N4 come semiconduttore privo di metalli per raccogliere la luce visibile e guidare reazioni chimiche, " ha detto Li. "Gli elettroni generati da C3N4 sotto irraggiamento luminoso hanno un'energia abbastanza alta da ridurre la CO 2 . Tali elettroni spesso non hanno una vita sufficientemente lunga da consentire loro di viaggiare sulla superficie del semiconduttore per l'uso nelle reazioni chimiche. Nel nostro studio, abbiamo adottato una strategia comune ed efficace per accumulare elettroni energetici sufficienti per il catalizzatore utilizzando un donatore di elettroni sacrificale. Questa strategia ci ha permesso di concentrarci sulla catalisi della CO 2 riduzione. In definitiva, vogliamo usare le molecole d'acqua come donatori di elettroni per la nostra catalisi, " Ha aggiunto.
Peipei Huang, un ricercatore post-dottorato nel laboratorio di Li, realizzato il catalizzatore semplicemente depositando ioni cobalto su un materiale C3N4 costituito da urea disponibile in commercio. Il team ha quindi esaminato a fondo il catalizzatore sintetizzato utilizzando una varietà di tecniche in collaborazione con Christine Caputo dell'Università del New Hampshire e Ronald Grimm del Worcester Polytechnic Institute.
Il catalizzatore ha funzionato in CO 2 riduzione sotto irraggiamento di luce visibile.
"Questo catalizzatore ha fatto quello che doveva fare:abbattere la CO 2 e produrre CO con un'ottima selettività alla luce visibile, " Frenkel ha detto. "Ma l'obiettivo successivo era vedere perché funzionava. Se riesci a capire perché funziona, puoi creare materiali nuovi e migliori basati su questi principi".
Così Frenkel e Li hanno fatto un brainstorming di esperimenti che avrebbero mostrato la struttura del catalizzatore con precisione. Gli studi strutturali darebbero agli scienziati informazioni sul numero di atomi di cobalto, la loro posizione rispetto agli atomi di carbonio e azoto, e altre caratteristiche che gli scienziati potrebbero potenzialmente adattare per cercare di migliorare ulteriormente il catalizzatore.
Si sono rivolti alla linea di luce Quick X-ray Absorption and Scattering (QAS) presso NSLS-II per utilizzare la spettroscopia di assorbimento dei raggi X. Con l'aiuto dello scienziato capo della linea di luce Steven Ehrlich, Lo studente di Frenkel Jiahao Huang ha preso i dati e ha analizzato gli spettri.
In questa tecnica, i raggi X di NSLS-II vengono assorbiti dagli atomi nel campione, che poi espellono onde di elettroni. Gli spettri mostrano come queste onde elettroniche interagiscono con gli atomi circostanti, simile al modo in cui le increspature sulla superficie di un lago vengono interrotte quando incontrano le rocce.
"Per essere in grado di eseguire la spettroscopia di assorbimento dei raggi X (XAS), dobbiamo sintonizzare e scansionare l'energia del raggio di raggi X che colpisce il campione, " ha detto Ehrlich. "Ogni elemento può assorbire i raggi X a energie distinte, chiamati bordi di assorbimento. Alla nuova linea di luce QAS possiamo scansionare l'energia dei raggi X attraverso l'energia del bordo di assorbimento di diversi elementi, come il cobalto in questo caso. Quindi misuriamo il numero di fotoni assorbiti dal campione per ciascun valore dell'energia dei raggi X".
Inoltre, Frenkel ha spiegato, "ogni tipo di atomo produce un diverso tipo di ripple elettronico, quando eccitato dai raggi X, o quando viene colpito da altre increspature, quindi lo spettro di assorbimento dei raggi X ti dice quali sono gli atomi circostanti e quanto sono distanti e quanti sono."
L'analisi ha mostrato che il catalizzatore abbattendo la CO 2 era costituito da singoli ioni di cobalto circondati su tutti i lati da atomi di azoto.
"Non c'erano coppie cobalto-cobalto. Quindi, questa era la prova che erano in realtà singoli atomi di cobalto dispersi sulla superficie, " ha detto Frenkel.
"Questi dati restringono anche le possibili disposizioni strutturali, che fornisce informazioni ai teorici per valutare e comprendere appieno le reazioni, " ha aggiunto Frenkel.
Sebbene la scienza delineata nel documento non sia ancora in uso pratico, ci sono abbondanti possibilità di applicazioni, ha detto Frenkel. Nel futuro, tali catalizzatori a sito singolo potrebbero essere utilizzati in aree su larga scala con abbondante luce solare per abbattere la CO . in eccesso 2 nell'atmosfera, simile al modo in cui le piante scompongono la CO 2 e riutilizzare i suoi elementi costitutivi per costruire zuccheri nel processo di fotosintesi. Ma invece di fare zuccheri, gli scienziati potrebbero utilizzare gli elementi costitutivi della CO per generare combustibili sintetici o altre sostanze chimiche utili.