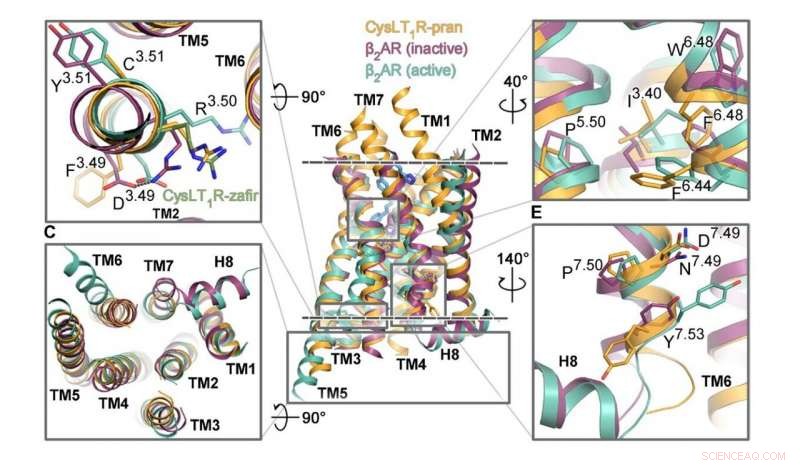
I segmenti del recettore CysLT1 responsabili della sua attivazione sono mostrati in arancione, accanto ad altri recettori accoppiati a proteine G. Credito:Luginina et al./Science Advances
Un team di ricerca del Centro MIPT per i meccanismi molecolari dell'invecchiamento e delle malattie legate all'età ha collaborato con colleghi degli Stati Uniti, Canada, Francia, e la Germania per determinare la struttura spaziale del recettore CysLT1. Il documento è stato pubblicato in Progressi scientifici .
Recettori accoppiati a proteine G, o GPCR, sono macchine molecolari incorporate nelle membrane cellulari. Questi recettori raccolgono segnali specifici all'esterno di una cellula e li trasmettono nella cellula. I segnali provengono da varie fonti, compresi i fotoni di luce, molecole di grasso, piccole proteine, e frammenti di DNA. Un GPCR può innescare diversi eventi nella cellula, come la divisione, trasferimento, o addirittura la morte.
La "comunicazione" cellulare mediata da GPCR è cruciale per il funzionamento di un organismo. Non c'è da stupirsi che questi recettori siano in qualche modo coinvolti in tutti i processi del nostro corpo. Sono gli obiettivi di circa il 40% dei farmaci esistenti, pure. Così, è interessante per i biologi strutturali comprendere il meccanismo di funzionamento di queste macchine biologiche e trovare un modo per influenzarle, sviluppando nuovi farmaci che possiedono più specificità e minori effetti collaterali.
La biologia strutturale è un campo interdisciplinare all'interfaccia tra fisica e biologia, interessati allo studio della disposizione 3-D delle macromolecole biologiche, come le proteine. Gli studi strutturali riguardano l'ingegneria genetica, produzione di proteine artificiali, purificazione, e cristallizzazione. Una volta ottenuto il cristallo proteico, entra in gioco la fisica:i ricercatori espongono il cristallo proteico a potenti raggi X per generare schemi di diffrazione. I dati risultanti possono essere elaborati matematicamente per recuperare una struttura atomica 3D dettagliata di una determinata molecola proteica, con una precisione fino a diversi angstrom.
Gli studi strutturali si basano su potenti sorgenti di raggi X. Questi sono tipicamente di due tipi:i sincrotroni e i laser a elettroni liberi sviluppati più di recente. In entrambi i casi, gli elettroni sono accelerati quasi alla velocità della luce. Sono quindi costretti a cambiare la loro velocità o direzione di movimento, che porta all'emissione di raggi X. In un sincrotrone, gli elettroni si muovono lungo una curva, percorso quasi circolare. In un laser a elettroni liberi, viaggiano attraverso un passaggio tra due file di magneti alternati diretti in modo opposto, noto come ondulatore.
Mentre i biologi strutturali hanno utilizzato i sincrotroni sin dagli anni '70, i laser a elettroni liberi sono un'aggiunta relativamente recente al kit di strumenti per la cristallografia proteica. Introdotto nei primi anni del 2010, generano radiazioni estremamente potenti e consentono l'analisi di diffrazione dei raggi X di minuscoli cristalli di 1 micrometro. Questo nuovo strumento ha già portato alla scoperta di diverse centinaia di strutture.
I ricercatori del MIPT hanno studiato la struttura di un GPCR noto come CysLT1. È coinvolto nei processi infiammatori e svolge un ruolo importante nelle malattie allergiche, compreso l'asma, che colpisce circa il 10% della popolazione mondiale. Il team di biofisici ha ottenuto la struttura tridimensionale dettagliata del recettore con le molecole di zafirlukast e pranlukast. Questi sono due farmaci prescritti a pazienti con asma, rinite allergica, e orticaria.
Sebbene relativamente grande, Nello studio sono stati coltivati cristalli da 0,3 millimetri con pranlukast, i cristalli con zafirlukast hanno raggiunto solo la dimensione di alcuni micrometri. I primi campioni sono stati studiati al sincrotrone ESRF di Grenoble, Francia. Questi ultimi sono stati esaminati utilizzando la Linac Coherent Light Source della Stanford University, un laser a elettroni liberi. I colleghi dei ricercatori canadesi hanno contribuito a esplorare i meccanismi di trasmissione del segnale tramite CysLT1.
"Si tratta senza dubbio di strutture uniche, e ci siamo affezionati molto a loro, " ha detto la coautrice dello studio Aleksandra Luginina del MIPT Laboratory of Structural Biology of G Protein-Coupled Receptors. "Il meccanismo di funzionamento del recettore CysLT1 aggiorna il modo in cui vediamo il funzionamento dei sottogruppi di proteine GPCR. Anche, identificando i siti di legame per le molecole zafirlukast e pranlukast, poniamo le basi per migliorare i farmaci per l'asma, aumentando la loro efficienza e riducendo gli effetti collaterali".
I GPCR sono notoriamente oggetti difficili per gli studi strutturali. Solo una manciata di laboratori in tutto il mondo è riuscita a portare a termine progetti di ricerca di questo tipo. Il team del MIPT è lieto che un laboratorio dell'Istituto sia ora tra loro.