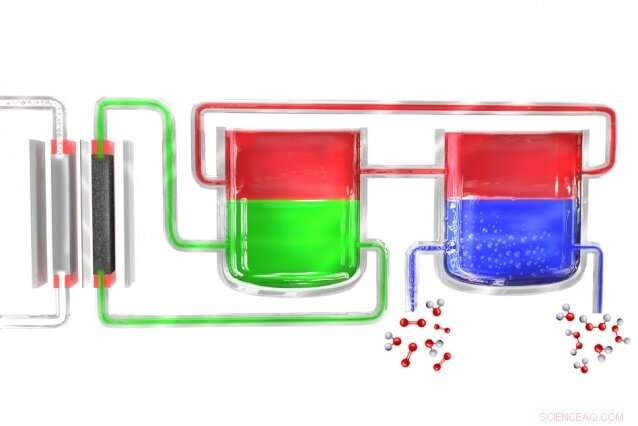
In un nuovo metodo per produrre perossido di idrogeno in modo portatile, un elettrolizzatore (a sinistra) divide l'acqua in idrogeno e ossigeno. Gli atomi di idrogeno si formano inizialmente in un materiale elettrolitico (verde), che li trasferisce a un materiale mediatore (rosso), che poi li trasporta in un'unità separata dove il mediatore entra in contatto con l'acqua ricca di ossigeno (blu), dove l'idrogeno si combina con esso per formare perossido di idrogeno. Il mediatore poi ritorna per ricominciare il ciclo. Credito:Massachusetts Institute of Technology
Perossido di idrogeno, un utile disinfettante multiuso, si trova nella maggior parte degli armadietti dei medicinali nel mondo sviluppato. Ma nei villaggi remoti dei paesi in via di sviluppo, dove potrebbe svolgere un ruolo importante per la salute e l'igiene, può essere difficile da trovare.
Ora, un processo sviluppato al MIT potrebbe portare a un semplice, poco costoso, dispositivo portatile in grado di produrre continuamente perossido di idrogeno dalla sola aria, acqua, ed elettricità, fornendo un modo per sterilizzare le ferite, superfici per la preparazione degli alimenti, e persino le riserve d'acqua.
Il nuovo metodo è descritto questa settimana sul giornale Joule in un articolo degli studenti del MIT Alexander Murray, Sahag Voskian, e Marcel Schreier e professori del MIT T. Alan Hatton e Yogesh Surendranath.
Anche a basse concentrazioni, il perossido di idrogeno è un efficace agente antibatterico, e dopo aver svolto la sua funzione sterilizzante si scompone in semplice acqua, a differenza di altri agenti come il cloro che possono lasciare sottoprodotti indesiderati dalla sua produzione e utilizzo.
Il perossido di idrogeno è solo acqua con un atomo di ossigeno in più attaccato:è H2O2, invece di H2O. Quell'ossigeno in più è legato in modo relativamente lasco, rendendolo una sostanza chimica altamente reattiva desiderosa di ossidare qualsiasi altra molecola attorno ad essa. È così reattivo che ad alte concentrazioni può essere usato come carburante per missili, e anche concentrazioni del 35 percento richiedono procedure di spedizione e movimentazione molto speciali. Il tipo usato come disinfettante domestico è in genere solo il 3% di perossido di idrogeno e il 97 percento di acqua.
Poiché le alte concentrazioni sono difficili da trasportare, e basse concentrazioni, essendo per lo più acqua, sono antieconomici da spedire, il materiale è spesso difficile da reperire in luoghi dove potrebbe essere particolarmente utile, come comunità remote con acqua non trattata. (I batteri nelle riserve idriche possono essere efficacemente controllati aggiungendo perossido di idrogeno.) Di conseguenza, molti gruppi di ricerca in tutto il mondo hanno perseguito approcci per sviluppare una qualche forma di attrezzatura portatile per la produzione di perossido di idrogeno.
La maggior parte del perossido di idrogeno prodotto nel mondo industrializzato è prodotto in grandi impianti chimici, dove il metano, o gas naturale, viene utilizzato per fornire una fonte di idrogeno, che viene poi fatto reagire con l'ossigeno in un processo catalitico ad alto calore. Questo processo è energivoro e non facilmente scalabile, che richiedono grandi attrezzature e una fornitura costante di metano, quindi non si presta a unità più piccole o località remote.
"C'è una comunità in crescita interessata al perossido di idrogeno portatile, "Surendranath dice, "per l'apprezzamento che avrebbe davvero soddisfatto molte esigenze, sia dal lato industriale che in termini di salute umana e igiene".
Altri processi sviluppati finora per sistemi potenzialmente portatili presentano limitazioni chiave. Per esempio, la maggior parte dei catalizzatori che promuovono la formazione di perossido di idrogeno dall'idrogeno e dall'ossigeno producono anche molta acqua, portando a basse concentrazioni del prodotto desiderato. Anche, processi che comportano l'elettrolisi, come fa questo nuovo processo, spesso hanno difficoltà a separare il perossido di idrogeno prodotto dal materiale elettrolitico utilizzato nel processo, di nuovo portando a una bassa efficienza.
Surendranath e il resto del team hanno risolto il problema suddividendo il processo in due fasi separate. Primo, l'elettricità (idealmente da celle solari o mulini a vento) viene utilizzata per scomporre l'acqua in idrogeno e ossigeno, and the hydrogen then reacts with a "carrier" molecule. This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. Nel processo, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath dice, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, he adds, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Così, Per esempio, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " lui dice.
"It's kind of an amazing process, " lui dice, "because you take abundant things, acqua, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, sale, base, eccetera., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, chi non era coinvolto in questo lavoro. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.