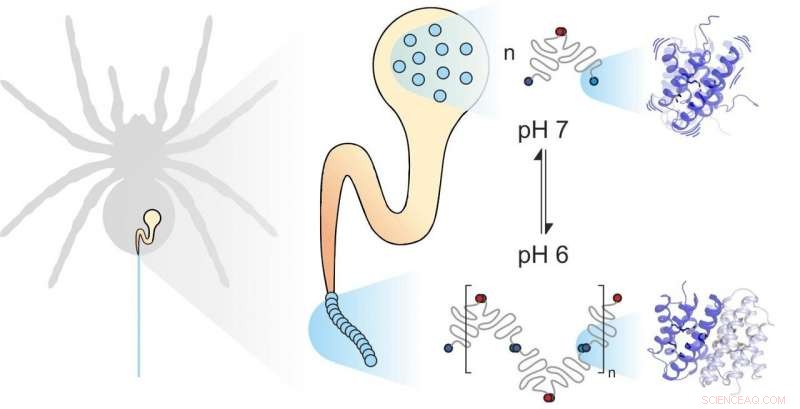
La seta di ragno è composta da singole proteine. I fattori meccanici e chimici influenzano il modo in cui si assemblano. La dinamica delle subunità gioca un ruolo importante. Credito:Benedikt Goretzki, Ute Hellmich
La seta di ragno è costituita da proteine che formano fibre, immagazzinato dal ragno in una ghiandola specializzata. Quando il ragno ha bisogno di seta, ad esempio per costruire un web, estrude le proteine della seta attraverso un lungo condotto in cui sono esposte a specifiche influenze meccaniche e chimiche e assemblate per formare la seta. proteine della seta di ragno, come tutte le proteine, sono costituiti da 20 elementi costitutivi elementari noti come amminoacidi. Il numero e la sequenza di questi amminoacidi determina le proprietà delle singole proteine. Per esempio, se gli amminoacidi idrofobici come la leucina si trovano al centro di una proteina, il risultato è una notevole stabilità strutturale. Quindi potresti aspettarti che la seta di ragno estremamente forte contenga molta leucina. Con loro grande sorpresa, però, scienziati delle università di Mainz e Würzburg hanno scoperto che un altro elemento costitutivo, metionina, è molto abbondante in alcune proteine della seta di ragno.
Le catene laterali della metionina sono note per essere altamente flessibili. "È stata questa abbondanza di metionina nella proteina della seta di ragno che ci ha fatto dare un'occhiata più da vicino alle sue dinamiche, " ha affermato la professoressa Ute Hellmich della Johannes Gutenberg University Mainz (JGU). "La nostra collaborazione con il team del dott. Hannes Neuweiler della Julius-Maximilians-Universität Würzburg (JMU) ci ha consentito di accedere a strumenti di ricerca biofisica all'avanguardia. "
Il gruppo di Würzburg ha sistematicamente sostituito l'amminoacido metionina nelle proteine della seta di ragno con la leucina e ha confrontato il ripiegamento, stabilità, e la dinamica delle varianti proteiche risultanti con l'aiuto della spettroscopia di correlazione di fluorescenza a trasferimento di elettroni fotoindotta (PET-FCS). Il Dr. Hannes Neuweiler è stato determinante nello sviluppo di questa tecnica, e il suo laboratorio è leader mondiale nell'utilizzarlo per studiare i sistemi biologici. Il team del professor Ute Hellmich ha quindi studiato la struttura e la dinamica delle due varianti proteiche utilizzando la spettroscopia di risonanza magnetica nucleare (NMR) ad alta risoluzione. "Effettuiamo le nostre misurazioni NMR presso il Centro per la risonanza magnetica biomolecolare dell'Università Goethe di Francoforte, un altro esempio del potenziale generato dalla nostra cooperazione nella rete dell'Università del Reno-Meno, " ha sottolineato Hellmich.
Gli elementi costitutivi della metionina nelle proteine della seta di ragno forniscono flessibilità
La combinazione della spettroscopia PET-FCS e NMR ha portato i due gruppi di ricerca alla conclusione inaspettata che la metionina nella proteina della seta di ragno aumenta la flessibilità della struttura proteica, e che questa flessibilità è precisamente ciò che consente alle singole proteine nella seta di ragno di interagire strettamente. "Abbiamo scoperto che la sostituzione della metionina con la leucina non ha alcun effetto sulla struttura delle proteine della seta di ragno. Infatti, entrambe le proteine hanno lo stesso aspetto. Allo stesso tempo, però, la proteina naturale contenente metionina si lega molto più fortemente ad altre proteine della seta di ragno. La proteina contenente leucina che abbiamo sintetizzato in laboratorio perde in gran parte questa capacità di formare legami così stabili, " ha sottolineato Benedikt Goretzki, un dottorando nel team di Hellmich e uno dei due principali autori dello studio pubblicato in Comunicazioni sulla natura . "Siamo rimasti davvero stupiti, poiché ciò dimostra che non è solo la forma di una proteina a determinarne il funzionamento, ma anche, in misura considerevole, la sua flessibilità».
"La metionina non solo rende la proteina più dinamica, migliora anche la sua funzionalità. In effetti, consente a due proteine di interconnettersi in modo specifico l'una con l'altra, che altrimenti sarebbe impossibile, anche se avevano la stessa struttura, " ha chiarito Julia Heiby, dottorando nel gruppo di Neuweiler e l'altro principale autore dello studio.
"La forma segue la funzione" è una regola pratica nella biologia strutturale. In altre parole, ciò che fa di solito una proteina può essere dedotto dalla sua struttura tridimensionale. "È impressionante come la natura possa anche influenzare la funzione delle proteine adattando con precisione le loro dinamiche, " ha aggiunto la professoressa biochimica di Magonza Ute Hellmich.
Sulla base di questi riscontri, potrebbe ora essere possibile modificare selettivamente le proprietà delle proteine della seta di ragno, Per esempio, sintetizzare nuovi biomateriali altamente stabili. Inoltre, i due gruppi sperano inoltre di fornire approfondimenti generali sulla rilevanza della dinamica delle proteine in relazione alle loro funzioni biologiche. "La dinamica delle proteine è importante in tutti gli aspetti della vita, " ha concluso Hellmich. "Questo vale sia per i ragni che per gli umani".