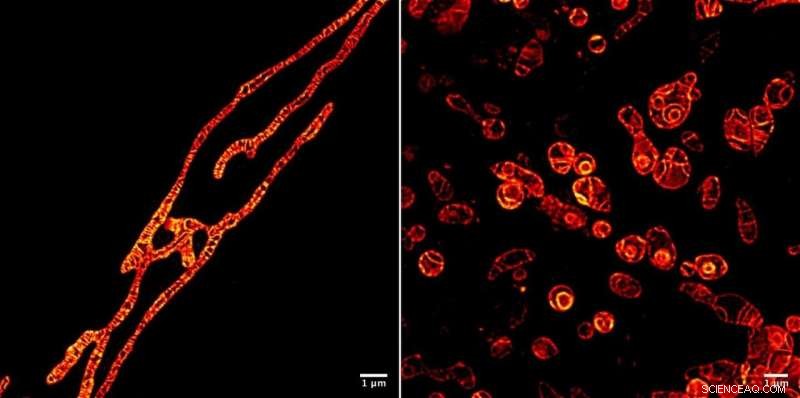
Membrane interne di mitocondri vivi al microscopio STED ripreso utilizzando la molecola di marcatore fluorescente MitoPB Yellow creata dai ricercatori dell'Istituto di biomolecole trasformative (ITbM) dell'Università di Nagoya. Le membrane esterne dei mitocondri sono invisibili. La molecola marcatore può resistere al raggio STED per un tempo relativamente lungo, che consente l'imaging time-lapse del soggetto dal vivo. La preparazione del campione è molto più semplice per un microscopio ottico rispetto a un microscopio elettronico a trasmissione (TEM), richiedendo circa un'ora piuttosto che un giorno. Le cellule non possono essere riprese vive usando TEM. I mitocondri sono stati trattati con un reagente che sopprime la replicazione del DNA, inducendo disfunzioni, per vedere i loro processi di sopravvivenza (a sinistra) e di morte (a destra). Essere in grado di vedere i processi di disfunzione che si verificano all'interno dei mitocondri porterà a un modo migliore di diagnosticare la malattia mitocondriale umana - e forse anche a una cura. Credito:© ITbM, Università di Nagoya
La microscopia ottica è l'unico modo in cui possiamo guardare all'interno di una cellula vivente, o tessuti viventi, in tre dimensioni. Un microscopio elettronico fornisce solo una visione bidimensionale, e il campione organico brucerebbe rapidamente a causa del calore estremo del fascio di elettroni, e quindi non può essere osservato vivo. Inoltre, marcando le biomolecole della struttura che ci interessa con una molecola fluorescente appositamente progettata, possiamo distinguerlo dall'ambiente circostante:questa è la microscopia a fluorescenza.
Fino alla metà degli anni '90 la microscopia a fluorescenza era ostacolata dalla fisica di base:a causa del limite di diffrazione, qualsiasi caratteristica del campione più vicina di circa 250 nanometri sarebbe sfocata insieme. I virus e le singole proteine sono molto più piccoli di così, quindi non potevano essere studiati in questo modo. Ma intorno al 1994, in una meravigliosa lezione che ci insegna che dobbiamo fare attenzione quando applichiamo i principi fisici fondamentali, Stefan Hell ha scoperto la microscopia con riduzione delle emissioni stimolate (STED), che ora è uno dei numerosi approcci di microscopia ottica che raggiungono "super-risoluzione, " risoluzione oltre il limite di diffrazione. Ha ricevuto il Premio Nobel per la Chimica nel 2014 "per lo sviluppo della microscopia a fluorescenza super-risolta, " insieme a Eric Betzig e William Moerner.
Per capire perché il limite di diffrazione è un problema, immagina che la struttura di interesse sia molto piccola, dire, 50 nanometri di diametro, come un virus, ed è stato marcato con una biomolecola fluorescente. Ora immagina di illuminarlo con un punto laser, dire, 200 nanometri di diametro. Le molecole di marker illuminate emettono luce spontaneamente, in momenti casuali, per fluorescenza, con la probabilità che diminuisca rapidamente nel tempo. I fotoni di molte molecole fluorescenti vengono focalizzati su un rivelatore che utilizza lenti, creando un singolo pixel senza caratteristiche. Non è completamente luminoso perché solo una piccola parte del campione nel cerchio illuminato contiene molecole fluorescenti. Se dovessi spostare il laser di 200 nanometri in qualsiasi direzione, per dove, in questo esempio, non sono presenti molecole fluorescenti, il segnale si spegnerà sicuramente. Così, questo pixel piuttosto debole ci dice che qualcosa è presente all'interno di questa area campione di 200 nanometri di diametro. Il limite di diffrazione ci impedisce di formare pixel da aree più piccole, se usiamo l'approccio di base.
L'idea fisica della microscopia STED è molto semplice. Con il punto laser che illumina nuovamente la regione intorno alla piccola struttura fluorescente, supponiamo di interrompere in qualche modo l'invio di luce al rilevatore da un'area quanto più ampia possibile all'interno del punto, lasciando un punto molto più piccolo, dire, 60 nanometri di diametro. Ora, se muovi il laser di 60 nanometri in qualsiasi direzione e il segnale si oscura, il pixel nell'immagine rappresenta la presenza di strutture fino a 60 nanometri di diametro. Il limite di diffrazione è stato superato. Certo, uno di questi pixel è privo di caratteristiche, ma un'immagine nitida dei mitocondri può essere costruita scansionando e registrando molti pixel di luminosità variabile. (Vedi Figura 1. "Microscopia STED Time-gated" è stata utilizzata per catturare la maggior parte delle immagini in questo documento.)
La scoperta di Stefan Hell, vincitrice del premio Nobel, consiste in due intuizioni. Primo, pensò all'idea di impedire che la luce venga inviata al rivelatore da un'area più ampia possibile all'interno di un punto illuminato la cui dimensione corrisponde al limite di diffrazione. Secondo, ha capito come ottenerlo effettivamente.
Due laser illuminano lo stesso punto. Il primo laser eccita gli elettroni della molecola marcatore e questi decadono spontaneamente al loro stato fondamentale, ciascuno emettendo un fotone visibile di una specifica lunghezza d'onda. (Questa è fluorescenza.) Il processo è casuale, con la probabilità di emissione che decresce con il tempo abbastanza rapidamente, il che significa che la maggior parte dei fotoni viene emessa entro i primi nanosecondi dall'illuminazione del campione. Un secondo laser, il "raggio STED, " sagomato con un foro nel mezzo in modo da non intaccare le molecole marker lì, è sintonizzato per stimolare l'emissione di un fotone dalla molecola marcatore eccitata nell'anello esterno. Ma come si distinguono questi fotoni dai fotoni emessi dal centro?
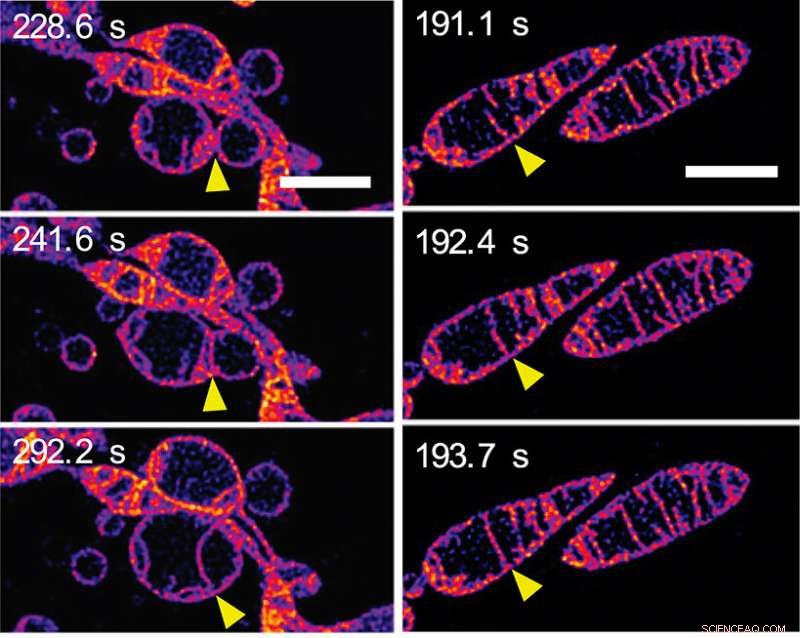
In risposta alla mancanza di nutrienti, i mitocondri si fondono insieme e aumentano il numero di creste. (a) Fotogrammi di una sequenza time-lapse che mostra due mitocondri separati che si fondono insieme per formare un singolo mitocondrio. Le membrane esterne dei mitocondri sono invisibili:stiamo vedendo le membrane interne fondersi insieme. (b) Fotogrammi di una sequenza time-lapse che mostra due creste all'interno di un singolo mitocondrio che si fondono insieme. (Vedi Video 2 nel materiale supplementare sulla pagina web PNAS del documento.) Le barre della scala rappresentano 2 mm. Credito:© ITbM, Università di Nagoya
Anche il processo di emissione dall'anello esterno è casuale ma avviene molto più rapidamente, la probabilità decresce rapidamente, il che significa che la maggior parte di questi fotoni viene emessa entro un nanosecondo circa. Mentre i due fasci sovrapposti scansionano il campione, quando il centro dell'anello diventa fluorescente, le molecole circostanti sono già state forzate nel loro stato fondamentale emettendo un fotone:sono state "spegne". La tecnica di microscopia STED si basa in questo modo su un tempismo intelligente. In linea di principio, la dimensione del punto centrale luminoso può essere ridotta a piacere, quindi qualsiasi risoluzione è possibile. Però, il "raggio STED" a forma di ciambella fornirebbe quindi energia sotto forma di luce laser visibile concentrata a un'area più ampia della cellula vivente, rischiando di ucciderlo.
Tuttavia, il processo non è ideale, e l'immagine risultante perde un po' di nitidezza perché alcune molecole di marker nell'anello esterno non sono correttamente disattivate:il processo è probabilistico, dopo tutto, e quando diventano fluorescenti contaminano il segnale dal centro. Però, a causa della diversa tempistica dell'emissione spontanea e stimolata, i primi fotoni ad arrivare al rivelatore provengono da regioni illuminate dalla più alta intensità del raggio STED, e gli ultimi fotoni ad arrivare sono molto probabilmente da molecole marker situate nel punto centrale. Quindi, aspettando un breve periodo (circa un nanosecondo) prima di registrare l'immagine, la maggior parte dei fotoni dall'anello esterno può essere filtrata. Questo è chiamato "microscopia STED Time-gated". L'ulteriore nitidezza dell'immagine si ottiene attraverso un processo chiamato deconvoluzione.
L'invenzione della microscopia a super risoluzione ha segnato un balzo in avanti nelle scienze della vita. Gli organismi viventi potevano essere osservati con una risoluzione senza precedenti. Però, sequenze di immagini time-lapse non potrebbero essere realizzate per un periodo di tempo decente perché le molecole di marcatore si degraderebbero sotto l'intenso raggio STED e smetterebbero di fluorescenza. Questo è il problema del photobleaching. Le molecole marcatrici danneggiate possono anche diventare tossiche per la cellula.
Il problema del photobleaching risolto
Shigehiro Yamaguchi e Masayasu Taki, dell'Istituto per le biomolecole trasformative (ITbM) dell'Università di Nagoya, ha guidato un gruppo di ricerca che ha sviluppato una molecola marcatore, denominato "MitoPB Giallo, "che viene assorbito dalla membrana interna dei mitocondri, comprese le creste, le strutture simili a pieghe, e ha una lunga durata sotto un raggio STED. L'idea per la molecola marcatore mirata ai mitocondri è venuta dal coautore Chenguang Wang, dell'ITbM. È anche possibile l'imaging STED multicolore con un singolo laser STED; e i ricercatori si aspettano che i marcatori fluorescenti simili a MitoPB Yellow dovrebbero trovare una vasta gamma di applicazioni anche in altre tecniche di super risoluzione (come quelle sviluppate da Eric Betzig e William Moerner).
Per dimostrare l'utilità pratica di MitoPB Yellow per l'imaging di cellule vive, il gruppo ha posto i mitocondri in condizioni che sono note per causare alcuni cambiamenti strutturali, ma fino ad ora questi sono stati osservati solo utilizzando la microscopia elettronica a trasmissione, che non può essere utilizzato su cellule vive. I mitocondri sono stati trattati con un reagente che sopprime la replicazione del DNA, inducendo disfunzioni, per osservare i loro processi di sopravvivenza e di morte.
Quindi, utilizzando la microscopia STED Time-gated, il team di ricerca ha realizzato immagini fisse con una risoluzione di 60 nanometri (circa un millesimo della larghezza di un capello umano), così come sequenze di immagini time-lapse che mostrano i mitocondri che rispondono a una privazione di nutrienti cambiando forma per sopravvivere. Le lunghe sequenze di immagini, fino a 600 immagini, sono le prime mai realizzate con mitocondri alla risoluzione spaziale relativamente elevata di 90 nanometri. (Vedi video 1, che mostra una sequenza time-lapse registrata in quasi 7 minuti.)
In pochi minuti la struttura mitocondriale interna è cambiata radicalmente in diversi modi. Inizialmente, si è visto allungamento e aumento del numero di creste. Una sequenza di immagini (vedi Figura 2a) mostra le membrane interne dei mitocondri vicini che si fondono insieme, in altre parole, due mitocondri che si fondono per formarne uno. Un'altra sequenza di immagini (vedi Figura 2b) mostra due creste all'interno di un singolo mitocondrio apparentemente fondendosi insieme. Si pensa che l'allungamento e la creazione di più creste aumentino l'efficienza della produzione di energia (sintesi di ATP) proteggendo il mitocondrio dalla "degradazione autofagosomica", una morte programmata il cui scopo è rimuovere componenti non necessari o disfunzionali dalla cellula e consentire la degradazione e il riciclaggio ordinati di componenti cellulari.
Dopo il periodo iniziale di allungamento, le membrane interne di alcuni mitocondri si dividono in globuli che si gonfiano e perdono le creste (vedi filmato S2); alcuni globuli si sono rotti (film S4). Alcune sfere concentriche formate (Figura 1 e Video 1). L'intensità della fluorescenza è rimasta la stessa. Degno di nota qui è che le creste e le membrane rimangono nitide come prima, il che indica che la causa della morte del mitocondrio non è la tossicità dovuta alla degradazione della molecola marcatore sotto il raggio. Il laser STED estremamente potente potrebbe aver danneggiato i mitocondri, anche se esattamente il motivo per cui si rompono è sconosciuto.
In queste immagini, dopo aver visto le risposte di sopravvivenza iniziali, stiamo osservando la morte dei mitocondri sotto l'intenso raggio STED. Una direzione futura della ricerca sarà quella di ridurre l'intensità del raggio laser STED creando una molecola marcatore fluorescente che si illumina quando viene illuminata da una luce di lunghezza d'onda più lunga e quindi di energia inferiore. I mitocondri potrebbero quindi vivere più a lungo.
Però, anche con MitoPB Yellow, il processo della morte, che non è ben compreso, può essere studiato. Nessuno sa se i cambiamenti morfologici (strutturali) osservati durante il processo di morte siano legati all'apoptosi (normale, morte controllata) o necrosi (morte per infortunio o malfunzionamento). È noto che l'apoptosi è innescata da una molecola di segnalazione chiamata citocromo C:se si trova un reagente che sopprime il citocromo C, allora i mitocondri e le cellule umane potrebbero vivere più a lungo.
Essere in grado di vedere i processi che si verificano all'interno dei mitocondri dovrebbe portare a un modo migliore di diagnosticare la malattia mitocondriale umana e forse anche a una cura.