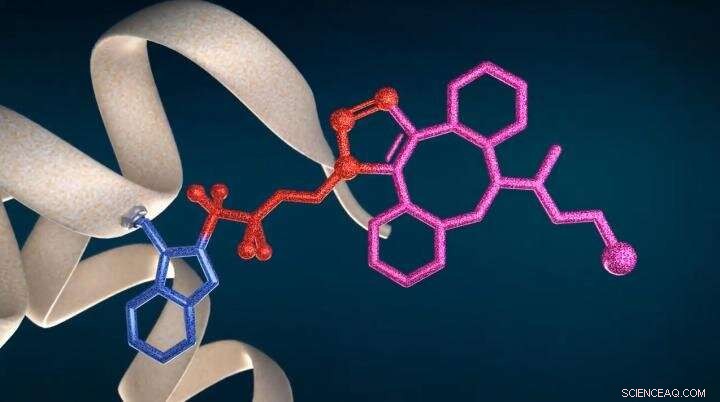
Nuova tecnologia CF LINK per la bioconiugazione proteica e la proteomica strutturale Credito:IOCB Praga (Fonte:youtu.be/a9IMvKv0UQU)
Ricercatori dell'Accademia ceca delle scienze e della start-up CF Plus Chemicals con sede a Brno, uno spin-off del Politecnico di Zurigo, ha segnalato una nuova tecnologia chiamata CF LINK per la bioconiugazione sito-selettiva delle proteine e la loro caratterizzazione strutturale. La tecnologia può preparare selettivamente coniugati proteici tramite i loro residui di triptofano ed eseguire modifiche post-traduzionali degli amminoacidi aromatici. Per di più, può essere utilizzato anche come strumento per la mappatura di superfici proteiche e studi di interazioni proteina-proteina.
L'azienda CF Plus Chemicals, uno spin-off dell'ETH di Zurigo fondato nel 2014, si basa su quasi 10 anni di collaborazione del gruppo del Dr. Petr Beier presso l'Istituto di Chimica Organica e Biochimica dell'Accademia Ceca delle Scienze (IOCB Praga) e del Dr. Václav Matoušek, un dottorato di ricerca alumnus del Prof. Dr. Antonio Togni all'ETH di Zurigo.
Reagenti a base di composti ciclici ipervalenti iodio-perfluoroalchilici, detti anche reagenti di Togni, sono diventati strumenti ampiamente utilizzati e popolari nella sintesi organica, specialmente in chimica medicinale per la preparazione di nuovi candidati farmaci fluorurati, in linea con la crescente domanda di scaffold fluorurati nella progettazione di farmaci. All'inizio degli anni '90, le molecole fluorurate rappresentavano il 5% del numero totale di farmaci approvati; ora comprendono il 15 per cento, e circa il 30 percento per le terapie di nuova approvazione.
Questa famiglia di composti chimici è stata successivamente ampliata nel 2013 in collaborazione con l'ETH di Zurigo e il Dr. Petr Beier di IOCB a una nuova generazione di reagenti Togni brevettati che trasportano un gruppo RCF2CF2 più complesso invece di un semplice gruppo CF3. La nuova famiglia di questi prodotti chimici condivide non solo la ricca reattività della prima generazione di reagenti Togni, ma mostrano anche una variabilità strutturale virtualmente illimitata del gruppo tetrafluoroetilico β-sostituito, che sono in grado di trasferire a una varietà di substrati rilevanti per la chimica medica delle piccole molecole.
Nel 2017, il potenziale applicativo dei reagenti Togni di seconda generazione è stato esteso alle proteine. La loro elevata affinità verso il gruppo tiolico consente alla bioconiugazione selettiva attraverso le cisteine di formare coniugati stabili che, a differenza dei coniugati maleimmidici, non sono soggetti a deconiugazione lenta e scambio tiolico.
La presente invenzione si basa sulla precedente conoscenza della natura radicalica delle reazioni mediate da reagenti di Togni. Nel progetto SME Instrument Horizon 2020, sostenuto dalla città di Brno e in collaborazione con IOCB e il Dr. Petr Novák dell'Istituto di microbiologia dell'Accademia ceca delle scienze (IMIC), è stato dimostrato che i reagenti Togni, quando mescolato con ascorbato di sodio, un economico, agente riducente atossico e biocompatibile, generano immediatamente radicali tetrafluoroetilici ß-sostituiti che si attaccano selettivamente ai residui di triptofano stericamente accessibili della proteina in condizioni prive di metalli di transizione.
Una volta che i gruppi azidofluoroalchilici sono attaccati alla proteina, vari gruppi funzionali, come i coloranti fluorescenti, i radionuclidi o le tossine ADC per l'oncoterapia mirata possono essere successivamente collegati tramite la reazione clic per fornire i corrispondenti coniugati proteici. Il metodo di bioconiugazione selettiva del triptofano divulgato non interrompe i ponti disolfuro proteico e offre una soluzione alternativa dove la coniugazione con cisteina convenzionale non è possibile, Per esempio, a causa di un indesiderato rimescolamento di disolfuro.
Questo metodo di bioconiugazione può essere esteso anche ad altri amminoacidi aromatici e quindi a proteine prive di triptofano. Così, è stato possibile modificare con successo l'insulina ricombinante umana e collegare fino a sette modifiche ai suoi amminoacidi aromatici, dimostrando il potenziale per la modifica post-traduzionale delle proteine.
La natura estremamente rapida di questa reazione mirata agli amminoacidi aromatici accessibili ai solventi lo rende uno strumento conveniente per mappare le superfici proteiche e studiare le interazioni proteina-proteina. Utilizzando l'esempio dell'anidrasi di carbonio umana, i ricercatori hanno dimostrato che i risultati della mappatura della superficie sono in eccellente accordo con la sua struttura nativa pubblicata.
Prof. Dott. Martin Fusek, CEO di IOCB Tech, dice, "La base dei risultati commerciali di successo dei risultati della ricerca di base è un eccellente lavoro scientifico. Questo è un risultato importante che è utile non solo come strumento per la ricerca di base ma anche come mezzo per lo sviluppo di nuovi farmaci a base di proteine. L'unicità, che dovrebbe essere piuttosto la regola, è che il progetto è stato creato dalla collaborazione di due istituzioni accademiche e una società commerciale. Sono molto contento che avremmo potuto essere parte del processo".
Dott. Petr Beier, capo di un gruppo di ricerca presso IOCB Praga, dice, "Sono lieto che siamo stati in grado di sviluppare una collaborazione interdisciplinare di successo di sintesi organica e biochimica. Risulta che le proprietà specifiche dei composti fluorurati possono essere utilizzate non solo tradizionalmente nella chimica medica di piccole molecole, ma come recentemente mostrato anche per la bioconiugazione di proteine e studi sulla loro struttura. Credo che in futuro saremo in grado di identificare altri usi interessanti dei reagenti Togni in biochimica".
Dott. Petr Novák, capo di un gruppo di ricerca presso IMIC, dice, "Grazie ai reagenti Togni siamo stati in grado di introdurre una sonda fluorurata nella struttura proteica in ambiente acquoso in pochi secondi. Ora siamo in grado di utilizzare questa tecnologia per etichettare selettivamente le proteine per la diagnostica clinica o utilizzarla per identificare l'interfaccia di interazione delle proteine con i loro ligandi".
Dott. Václav Matoušek, CEO di CF Plus Chemicals, dice, "Sono entusiasta di vedere che la reattività dei reagenti Togni potrebbe essere estesa agli amminoacidi aromatici e agli aromi in generale, aprendo così una miriade di potenziali applicazioni, soprattutto nella scienza delle proteine e nelle terapie a base di proteine. Ora stiamo attivamente cercando partner industriali affermati che possano applicare la nostra tecnologia per risolvere le loro sfide".