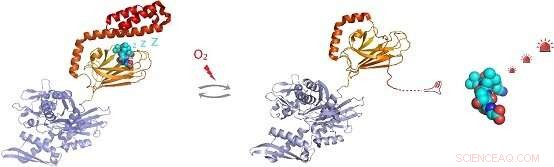
Figura:In condizioni di stress ossidativo, lo chaperone molecolare Hsp70 subisce modificazioni post-traduzionali dei residui di cisteina mediante l'aggiunta del tripeptide glutatione. La glutationilazione all'interno del dominio di legame al substrato di Hsp70 fa sì che la regione elicoidale C-terminale di Hsp70 si disfa e occupi il proprio sito di legame al substrato. Ciò impedisce il legame, consentendo l'attivazione di substrati molecolari di segnalazione come il fattore di trascrizione dello shock termico Hsf1. Credito:gruppo della Dott.ssa Sarah Perrett
Le proteine Heat Shock Protein 70 (Hsp70) sono una famiglia di chaperoni molecolari antichi e conservati. Svolgono un ruolo essenziale nel mantenimento dell'omeostasi proteica, compresa la facilitazione del ripiegamento e della degradazione delle proteine, prevenire l'aggregazione proteica, e partecipando alla risposta allo stress. L'interruzione del meccanismo di controllo della qualità cellulare è associata all'invecchiamento, cancro e malattie neurodegenerative.
Il ruolo delle modificazioni post-traduzionali (PTM) nella regolazione delle funzioni di Hsp70 è un campo di ricerca emergente. Sebbene lo stress ossidativo possa essere dannoso, la variazione redox è una caratteristica naturale dell'ambiente cellulare e facilita la trasduzione del segnale per importanti attività fisiologiche. Le modificazioni della cisteina delle proteine forniscono il mezzo principale per il trasferimento del segnale redox. La glutationilazione è una modifica reversibile dei residui di cisteina nelle proteine, che possono proteggere le proteine dall'ossidazione irreversibile, e può anche svolgere un ruolo nella trasduzione del segnale.
In questo studio, la glutationilazione di diversi membri della famiglia Hsp70 è stata rilevata nelle cellule HeLa e i siti di modifica sono stati accertati mediante spettrometria di massa dai ricercatori della prof.ssa Sarah Perrett e del gruppo del prof. Chen Chang presso l'Istituto di biofisica dell'Accademia cinese delle scienze.
Concentrandosi sullo stress inducibile Hsp70 HspA1A (hHsp70), è stato studiato il meccanismo strutturale dettagliato di come la glutationilazione influenza l'attività proteica e le interazioni proteina-proteina.
Il rilevamento in vivo ha mostrato che ciascuno dei cinque residui di cisteina di hHsp70 può subire glutationilazione. Esperimenti in vitro hanno rivelato che la modifica delle cisteine nel dominio di legame dei nucleotidi di hHsp70 è impedita dal legame dei nucleotidi, ma che Cys-574 e Cys-603, situato nel coperchio α-elicoidale C-terminale del dominio di legame al substrato, possono subire glutationilazione sia in presenza che in assenza di nucleotide.
Risolvendo la struttura NMR della forma glutationilata di hHsp70 SBD, è stata dimostrata la base strutturale per i cambiamenti funzionali. La glutationilazione di questi residui di cisteina provoca il dispiegamento della struttura α-elica del coperchio. La regione spiegata imita il substrato legandosi e bloccando il sito di legame del substrato, promuovendo così l'attività intrinseca dell'ATPasi, e competere con il legame di substrati esterni. Questo porta ad una riduzione della sua capacità di legare altre proteine substrato, come il fattore di shock termico Hsf1.
Questi risultati indicano non solo che la modificazione della cisteina può alterare la struttura e la funzione di hHsp70, ma anche che hHsp70 può trasferire informazioni redox ai suoi client.
Questo studio è stato pubblicato su Journal of Biological Chemistry il 12 giugno 2020.