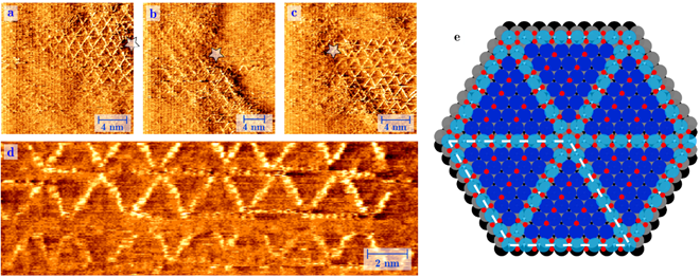
A sinistra:immagine realizzata con un microscopio a scansione a effetto tunnel (STM). Immagine di una superficie di platino sotto una pressione di 1 atmosfera di ossigeno a 256 °C. In queste circostanze, vediamo la crescita spontanea di una struttura a ruota a raggi di file di PtO2 incorporate con molti errori strutturali. A destra:gli atomi di platino ossidato in azzurro, gli atomi di ossigeno in rosso e gli atomi di platino regolari in superficie in blu scuro (strato 1), grigio (strato 2) e nero (strato 3). Credito:Università di Leiden
Le auto sono dotate di catalizzatori per disarmare i gas di scarico tossici. Il platino gioca un ruolo importante lì. Fisici e chimici di Leida hanno ora visto per la prima volta il meccanismo alla base di un catalizzatore al platino. Con una comprensione fondamentale del processo, gli scienziati possono utilizzare questo materiale raro in modo più efficiente. Pubblicazione in Comunicazioni sulla natura .
I gas di scarico di oltre un miliardo di auto in tutto il mondo contribuiscono in modo significativo al riscaldamento globale. Ma senza catalizzatori, le auto sarebbero ancora più inquinanti. Dopo che i gas di scarico tossici lasciano il motore, i catalizzatori li convertono in sostanze meno nocive. Il platino gioca un ruolo importante qui, eliminando il monossido di carbonio tossico. Questo metallo nobile è molto raro e quindi gli scienziati stanno studiando come usarlo nel modo più efficiente possibile.
Platino
Il platino funge da catalizzatore raccogliendo atomi di ossigeno (O), e lasciandoli legare con il monossido di carbonio tossico (CO), per creare l'anidride carbonica (CO2) meno dannosa. Il fisico Joost Frenken e i chimici Irene Groot e Matthijs van Spronsen dell'Università di Leiden hanno ora per la prima volta immaginato come funziona questo processo a livello atomico. Con uno speciale microscopio autocostruito hanno visto crescere uno strato di ossigeno ultrasottile su una superficie di platino. Ciò è accaduto in circostanze realistiche, cioè alla stessa alta pressione e temperatura come all'interno di un motore, che ha reso l'esperimento ancora più difficile. I ricercatori hanno scoperto che gli atomi di ossigeno sono un po' "allentati, " in modo che possano reagire facilmente con altre sostanze. Ciò fornisce per la prima volta una buona spiegazione per l'elevata attività catalitica del platino nelle reazioni di ossidazione.
Efficienza
Svelando il meccanismo dietro il catalizzatore al platino, gli scienziati di Leiden contribuiscono a una migliore comprensione fondamentale della catalisi. A lungo termine, gli scienziati potrebbero sfruttare questa conoscenza per utilizzare materiali rari come il platino in modo più efficiente. Groot:"Allora o abbiamo bisogno di meno platino per ottenere lo stesso risultato, oppure comprendiamo così bene il meccanismo di catalisi alla base del platino da poter creare un materiale sostitutivo".