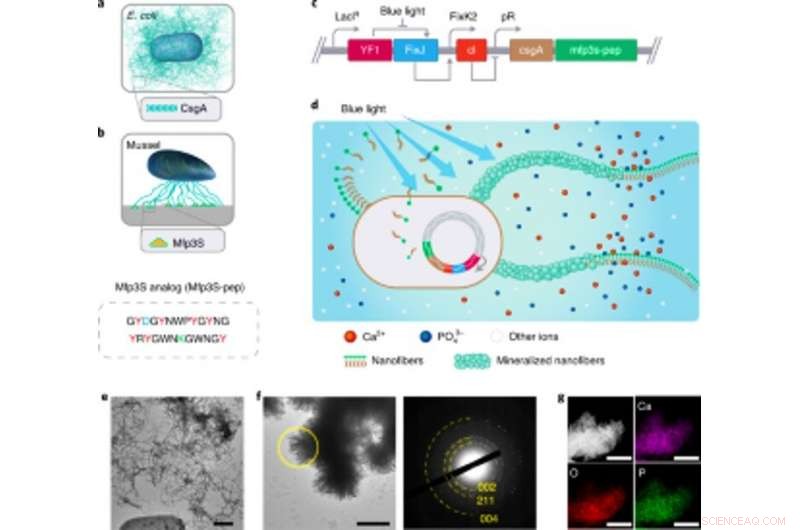
Ingegneria di biofilm funzionali di E. coli sensibili alla luce come scaffold per la mineralizzazione dell'HA. Ingegneria di biofilm funzionali di E. coli sensibili alla luce come scaffold per la mineralizzazione dell'HA. (a) Illustrazione schematica di biofilm di E. coli wild-type comprendenti nanofibre di amiloide CsgA extracellulare, che sono i principali componenti proteici del biofilm che contribuiscono alla robusta aderenza dei biofilm alle superfici solide. (b) Illustrazione schematica di Mfps dalle placche adesive della cozza della California M. californianus. Mfp3S-pep (sotto) è un peptide adesivo bioispirato che imita la proteina Mfp3S originale che si trova nelle placche adesive di M. californianus. Mfp3S-pep è arricchito con acido aspartico (blu), residui di lisina (verde) e tirosina (rosso), noti per i loro ruoli funzionali nel promuovere la nucleazione, crescita e adesione di HA. (c) Schema che mostra i componenti genetici del biofilm di E. coli sensibile alla luce. La progettazione di biofilm funzionali è stata resa possibile fondendo sequenze che codificano per la proteina CsgA e Mfp3S-pep, entrambi posizionati a valle dell'elemento di controllo trascrizionale pDawn sensibile alla luce. Nel circuito pDawn, l'espressione costitutiva dell'istidina chinasi YF1 e del suo regolatore di risposta affine FixJ è strettamente regolata dal promotore LacIq, mentre l'espressione del repressore del fago λ cI è controllata dal promotore FixK2. All'illuminazione a luce blu, l'attività chinasica di YF1 e la conseguente espressione di cI sono entrambe inibite, che a sua volta attiva il promotore λ pR per promuovere l'espressione di CsgA–Mfp3S-pep. (d) Schema che mostra la deposizione locale di minerali HA sulle nanofibre extracellulari funzionali composte da proteine di fusione CsgA-Mfp3S-pep, secreto da E. coli fotosensibile ingegnerizzato, il ceppo lightreceiver-CsgA– Mfp3S-pep. (e) Immagine TEM che mostra cellule e matrice extracellulare con abbondanti fibre amiloidi nei biofilm. Barra della scala, 500 nm. F, Immagine TEM che mostra i cristalli compositi formati e simili a listelli precipitati sulle superfici delle nanofibre extracellulari dopo 7 giorni di mineralizzazione in 1,5 × SBF. Il corrispondente pattern SAED presenta archi di diffrazione assegnati a (002), (211) e (004) aerei. Barra della scala, 500 nm. G, Mappatura EDS che illustra il Ca, Elementi O e P intrinsecamente assegnati alla fase HA. Barre della scala, 500 nm. Credito: Natura chimica biologia , doi:https://doi.org/10.1038/s41589-020-00697-z
Gli organismi viventi hanno evoluto meccanismi di biomineralizzazione per costruire materiali compositi strutturalmente ordinati e adattabili all'ambiente. Mentre i team di ricerca hanno notevolmente migliorato la ricerca sulla mineralizzazione biomimetica in laboratorio, è ancora difficile progettare compositi mineralizzati con caratteristiche strutturali e componenti viventi molto simili alle loro controparti native. In un nuovo rapporto ora pubblicato su Natura chimica biologia , Yanyi Wang e un gruppo di ricerca in fisica, materiale avanzato, biologia sintetica, e ingegneria in Cina, ha sviluppato compositi viventi modellati e sfumati ispirati a materiali naturali classificati. Hanno accoppiato la formazione di biofilm batterico inducibile dalla luce con la mineralizzazione biomimetica di idrossiapatite (HA) in questo lavoro, per mostrare come la posizione e il grado di mineralizzazione potrebbero essere controllati. Le cellule nei compositi sono rimaste vitali mentre rilevavano e rispondevano ai segnali ambientali. I compositi hanno mostrato un aumento di 15 volte del modulo di Young (cioè, rigidità, il rapporto tra sollecitazione e deformazione) dopo la mineralizzazione. Il lavoro fa luce per sviluppare compositi viventi con reattività dinamica e adattabilità ambientale.
Biomineralizzazione in laboratorio
L'organismo vivente può produrre una varietà di strutture composite gerarchiche organico-inorganiche basate sulla biomineralizzazione, dove esempi notevoli includono i denti radulari dei chitoni, squame di pesce e mandibole di gamberi che svolgono diverse funzioni biologiche. I tempi e il grado di biomineralizzazione devono essere controllati con precisione dalle cellule per formare strutture e funzioni accurate negli organismi viventi. Recenti ricerche sulla mineralizzazione biomimetica hanno evidenziato l'importanza di esplorare approcci controllati dalle cellule per produrre modelli viventi e compositi graduati come un'area promettente ma in gran parte inesplorata. Le discipline della biologia sintetica e della scienza dei materiali hanno scatenato una serie di circuiti genetici sofisticati e rispettosi dell'ambiente per bioingegnerizzare una serie di nuove funzioni cellulari. In questo lavoro, Wang et al. sviluppato bioispirato, materiali compositi viventi sfruttando biofilm di Escherichia coli inducibili dalla luce accoppiati con mineralizzazione biomimetica. Il lavoro aprirà le porte per integrare celle ingegnerizzate per produrre materiali mineralizzati con caratteristiche strutturali e viventi.
Mineralizzazione spazialmente controllabile di biofilm inducibili dalla luce per compositi modellati viventi. (a) Schema del setup sperimentale e dei passaggi sequenziali per la produzione di compositi modellati viventi. Il motivo a foglia blu raffigurato nell'illustrazione è stato proiettato su una capsula di Petri contenente il ceppo lightreceiver-CsgA-Mfp3S-pep sospeso nel mezzo. La luce blu innesca la formazione di biofilm funzionale attraverso l'espressione regolata dalla luce delle proteine CsgA-Mfp3S-pep dal ceppo lightreceiver-CsgA-Mfp3S-pep. Il mezzo di coltura nella capsula di Petri è stato quindi sostituito con 1,5× SBF, seguita da incubazione a 37 ° C per formare compositi. Dopo il processo di mineralizzazione, aTc è stato aggiunto per indurre l'espressione di una proteina fluorescente rossa (mCherry). (b) Immagine della fotocamera digitale dei biofilm modellati colorati con CV. Barra della scala, 1 cm. (c) Immagini SEM che mostrano la morfologia superficiale dei biofilm modellati. Barre della scala:2 µm (sinistra), 1µm (a destra). (d) Immagine della fotocamera digitale del successivo composito mineralizzato che ha mantenuto il modello originale. Barra della scala, 1 cm. (e) Immagini SEM che mostrano le microstrutture superficiali del composito mineralizzato. Barre della scala:2 µm (sinistra), 1µm (a destra). (F, g) Analisi al microscopio confocale a scansione laser della vitalità batterica in biofilm (f) e compositi (g). Barre della scala, 5µm. Si noti che il colorante SYTO 9 e il PI sono stati applicati come agenti di etichettatura per colorare le cellule vive (verdi) e morte (rosse), rispettivamente. (h) Fluorescenza indotta del composito vivente registrata con un sistema ChemiDoc XRS. Barra della scala, 1 cm. io, La microscopia confocale ha dimostrato l'espressione di mCherry dai batteri nel composito. Barra della scala, 20µm. J, Immagini confocali di un composito vivente dopo aver indotto l'espressione di mCherry ed etichettato con calceina, che indicava una distribuzione omogenea di componenti organici e minerali inorganici all'interno dei compositi viventi modellati. Barre della scala, 20µm. Credito: Natura chimica biologia , doi:https://doi.org/10.1038/s41589-020-00697-z 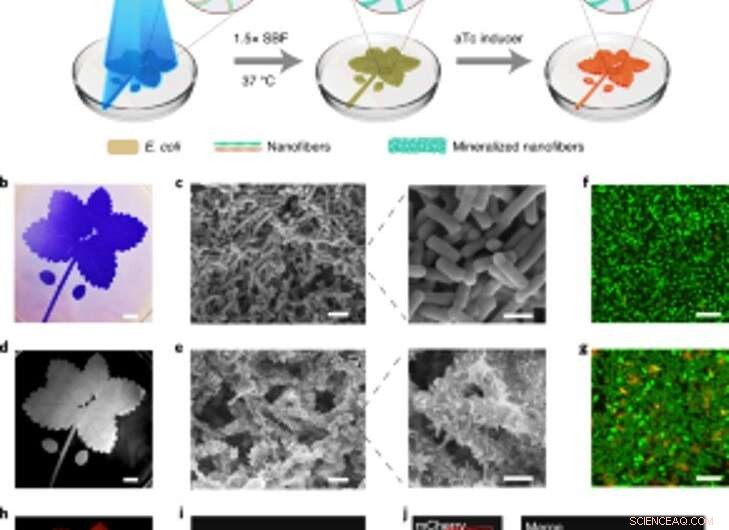
Il team ha selezionato le proteine di fusione per progettare la mineralizzazione che promuove i biofilm di E. coli. Sulla base di esperimenti precedenti, hanno selezionato la proteina Mefp5 – proveniente da Mytilus edulis, seguito da Mfp3S - originato da Mytilus californianus e un'altra variante del peptide Mfp3S (Mfsp3S-pep) per avviare la mineralizzazione e promuovere l'adesione. Il team ha costruito proteine di fusione contenenti un importante dominio proteico del biofilm di E. coli per formare proteine di fusione CsgA-Mfp e ha confermato la loro potenziale secrezione da cellule ingegnerizzate. Hanno quindi selezionato la proteina di fusione CsgA-Mfp3S-pep come rappresentante per la mineralizzazione dell'idrossiapatite e hanno condotto esperimenti per verificare la funzione della proteina per evidenziare il loro ruolo durante la mineralizzazione e la formazione dei cristalli. Successivamente, Wang et al. costruito un ceppo inducibile dalla luce per la formazione di biofilm chiamato light ricevitore -CsgA-Mfp3S-pep che può essere regolato strettamente tramite l'illuminazione a luce blu.
Il ceppo sensibile alla luce potrebbe generare materiali biofilm funzionali dopo l'illuminazione con la luce per promuovere la mineralizzazione dell'idrossiapatite (HA). Per convalidare questo, gli scienziati hanno esposto il ceppo sensibile alla luce alla luce blu in una capsula di Petri e hanno utilizzato la colorazione istologica e l'imaging al microscopio elettronico a trasmissione (TEM) per mostrare la produzione di fibre amiloidi nei biofilm. Comparativamente, non hanno osservato fibre amiloidi in campioni cresciuti al buio. La matrice extracellulare ingegnerizzata ha anche agito come modello per la mineralizzazione dell'HA nel tempo, che hanno confermato dopo 7 giorni di incubazione basata su tecniche di diffrazione dei raggi X (XRD) e spettroscopia a raggi X a dispersione di energia (EDS).
Mineralizzazione controllabile dalla densità in biofilm a gradiente regolati dall'intensità della luce utilizzati per fabbricare compositi livellati viventi. (a) Illustrazione schematica che mostra la generazione di compositi a gradiente vivente attraverso la mineralizzazione in situ di biofilm con densità di biomassa a gradiente. I biofilm gradiente sono stati formati proiettando luce con intensità variabili e controllo spaziale preciso sulla capsula di Petri contenente il ceppo lightreceiver-CsgA-Mfp3S-pep sospeso nel mezzo. (b) Immagine della fotocamera digitale che mostra biofilm colorati con CV con densità di biomassa a gradiente. Barra della scala, 1 cm. (c) Immagine della fotocamera digitale di compositi viventi a gradiente successivamente formati dopo la mineralizzazione dell'HA. Barra della scala, 1 cm. (d) Lo spessore dei biofilm e dei compositi successivamente mineralizzati formati sotto diverse intensità di luce. I risultati sono presentati come media ± s.d. I dati sono rappresentativi di n= 5 esperimenti indipendenti. (e) Micrografie SEM sezionali che mostrano le morfologie di diverse regioni (A1-A4) nei biofilm con intensità luminosa graduata. Barre della scala, 10µm. L'immagine nel riquadro (presa dalla regione A4) rappresenta la tipica morfologia superficiale dei biofilm. Barra della scala, 1 µm. (f) Micrografie SEM sezionali che mostrano le morfologie di diverse regioni (B1-B4) nei compositi a gradiente vivente come modellate da scaffold di biofilm con intensità luminosa graduata. Barre della scala, 10µm. L'immagine dell'inserto (presa dalla regione B4) rappresenta la tipica morfologia superficiale dei compositi a gradiente mineralizzato. Barra della scala, 1 µm. Notare che le percentuali di opacità del 100%, 50%, 25% e 12,5% corrispondono a intensità luminose effettive di 0,0306 W cm-2, 0,0268 W cm-2, 0,0178 W cm-2 e 0,0140 W cm-2, rispettivamente. Credito: Natura chimica biologia , doi:10.1038/s41589-020-00697-z 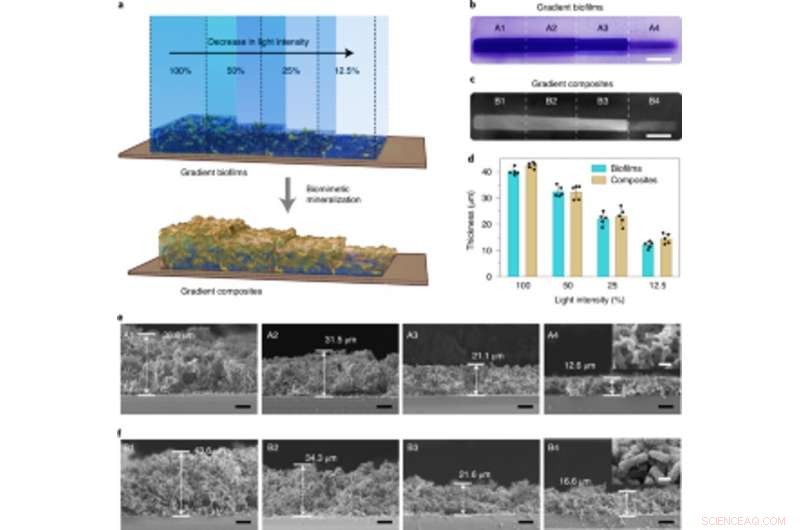
Sulla base della natura sensibile alla luce dei biofilm ingegnerizzati, Wang et al. formazione di biofilm manipolata nello spazio-tempo per controllare la formazione di compositi. Ci sono riusciti illuminando un motivo fogliare su colture batteriche liquide in piastre di Petri in polistirene che ricapitolavano fedelmente il motivo luminoso proiettato sui biofilm batterici. Dopo 7 giorni di mineralizzazione, il composito generato nelle piastre di Petri ha mantenuto il modello originale come osservato utilizzando la microscopia elettronica a scansione. L'approccio regolato dalla luce controllava la forma del composito sulla base di proiezioni a griglia e risoluzione spaziale della luce su microscala, paragonabile alle dimensioni dei batteri viventi. Il team ha quindi verificato la fattibilità del live, cellule intatte ingegnerizzando i compositi viventi per esprimere proteine fluorescenti, come confermato utilizzando immagini di microscopia confocale. Successivamente, hanno utilizzato l'analisi termogravimetrica per quantificare i componenti inorganici dei compositi mineralizzati, dove il materiale inorganico aumenta proporzionalmente con il tempo di immersione nel fluido corporeo simulato (SBF). Wang et al. ha anche confrontato il modulo di Young del biofilm utilizzando una tecnica di micro-indentazione per mostrare come la mineralizzazione ha rafforzato i biofilm di E. coli per proteggere le cellule.
Compositi a gradiente controllato a densità
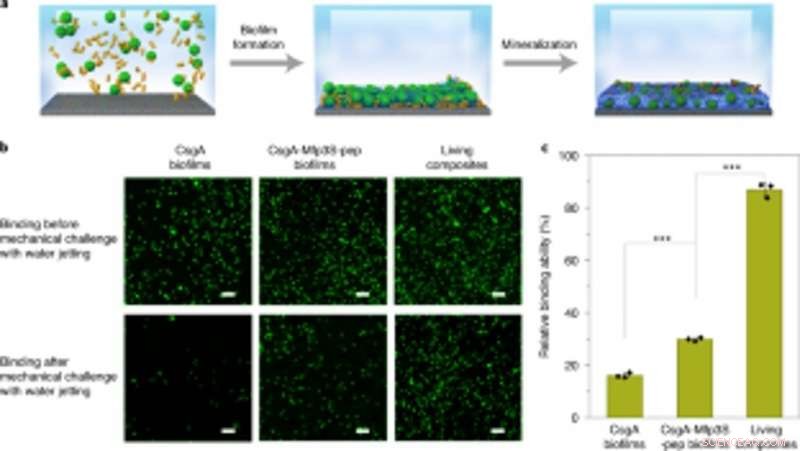
Accoppiamento di biofilm ingegnerizzati con mineralizzazione per una robusta cattura e immobilizzazione di microsfere su substrati. (a) Schema che mostra la cattura e l'immobilizzazione di microsfere su un vetrino in soluzione. Le microsfere di PS sospese nel mezzo di coltura sono state catturate e immobilizzate su un substrato attraverso la formazione di biofilm seguita da mineralizzazione in fluido corporeo simulato (SBF) 1,5x. (b) Immagini fluorescenti che mostrano i due tipi di biofilm (colonne sinistra e centrale) e microsfere viventi immobilizzate in composito (colonna destra) sui substrati prima (in alto) e dopo (in basso) la sfida con getto d'acqua a una pressione di scarico costante di 8 psi. Barre della scala, 100µm. (c) Quantificazione delle capacità relative di diversi biofilm e compositi viventi di incollare e immobilizzare microsfere PS sul substrato. I risultati sono presentati come media ± s.d. Da sinistra a destra:P= 0,00003, P= 0.000004. *P < 0.05, **P < 0.01, ***P < 0,001. Le statistiche sono derivate utilizzando un test t a due code. I dati sono rappresentativi di n= 3 esperimenti indipendenti. Credito: Natura chimica biologia , doi:https://doi.org/10.1038/s41589-020-00697-z
Gli approcci di ingegneria tissutale hanno sottolineato la necessità di identificare con precisione tra i tessuti duri e molli per prestazioni fisiologiche di successo, quindi l'intensità della luce potrebbe essere sintonizzata per controllare la densità e le proprietà meccaniche dei materiali viventi ingegnerizzati. Zhang et al. ottenuto ciò esponendo le colture di E. coli a diverse intensità di illuminazione per rivelare come lo spessore del biofilm diminuisse con la diminuzione dell'intensità della luce blu. Hanno inoltre mostrato come la mineralizzazione fosse strettamente e localmente diretta dalle proteine di fusione Mfsp3S-pep ingegnerizzate. Quindi hanno studiato le proprietà meccaniche locali delle regioni illuminate con micro-indentazione per osservare un aumento di quattro volte del modulo di Young per evidenziare i compositi viventi progettati con gradienti minerali regolabili e proprietà meccaniche per interfacce rigenerative tessuto-osso nelle applicazioni di ingegneria del tessuto osseo.
Distribuzione di compositi viventi per la riparazione di danni specifici del sito
Gli scienziati hanno anche studiato la capacità dei biofilm ingegnerizzati di aggregarsi per riparare i danni incollando microsfere di polistirene, insieme alla mineralizzazione dell'HA. Come prova di concetto, hanno applicato compositi viventi mineralizzati per riempire e riparare crepe progettate sulla superficie di una capsula di Petri in polistirene. Durante gli esperimenti, i biofilm adesivi fotoindotti hanno catturato le microsfere in soluzione per riempire il solco danneggiato appositamente creato, mentre le nanofibre nei biofilm hanno agito come modello per la mineralizzazione dell'idrossiapatite per consolidare la cementazione indotta dalla luce sotto l'illuminazione a luce blu. Utilizzando la microscopia elettronica a scansione, Wang et al. ha mostrato come i batteri e la matrice extracellulare circostante aderivano insieme alle microsfere per illustrare la funzione adesiva dei biofilm viventi. I compositi HA-mineralizzati si sono formati densi, strati simili al cemento che hanno limato il solco danneggiato per evidenziare la funzionalità di mineralizzazione dei compositi viventi per una maggiore durata e applicazioni di riparazione.
Applicazione della mineralizzazione vivente controllabile per la riparazione di danni specifici del sito. (a) Schema che mostra l'applicazione di compositi mineralizzati viventi per riempire e riparare crepe sulla superficie di una capsula di Petri PS. Da sinistra a destra:solco di danno sul substrato della capsula di Petri, i biofilm adesivi fotoindotti catturano le microsfere in soluzione per riempire il solco di danno, e le nanofibre nei biofilm fungono da modello per la mineralizzazione dell'HA per consolidare il cemento. (b) Immagine SEM che mostra il solco di danno. Sotto, un diagramma schematico che illustra le dimensioni del solco di danno. Barra della scala, 50µm. C, Immagini SEM che mostrano la morfologia del solco di danno riempito con il biofilm e le microsfere. Barre della scala:50 µm (in alto), 5µm (in basso). (d) immagini SEM che mostrano la morfologia del solco di danno dopo la mineralizzazione; HA riempie gli spazi tra le sfere. Barre della scala:50 µm (in alto), 5µm (in basso). Si noti che gli esperimenti di riparazione dei danni specifici del sito sono stati ripetuti almeno tre volte con risultati identici. Credito: Natura chimica biologia , doi:10.1038/s41589-020-00697-z 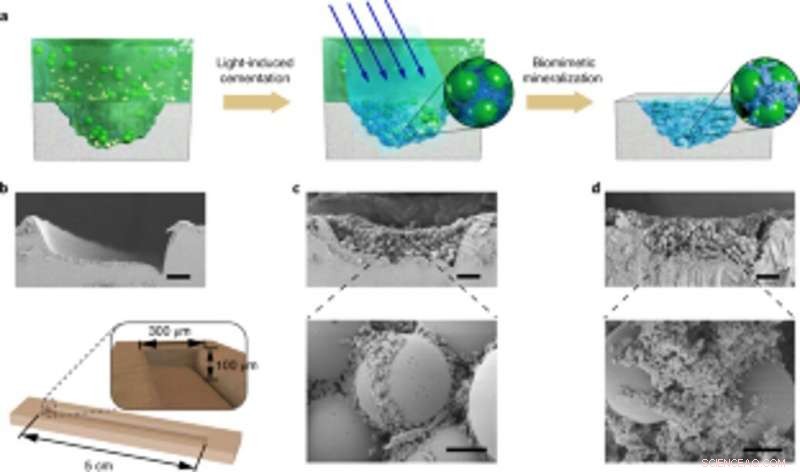
In questo modo, Yanyi Wang e colleghi hanno prodotto compositi con modelli viventi bioispirati e compositi con classificazione vivente con una piattaforma di biofilm regolata dalla luce. I compositi risultanti hanno mostrato una reattività ambientale simile alle loro controparti native. Le cellule all'interno dei compositi sono rimaste vitali e hanno risposto agli stimoli ambientali anche dopo la mineralizzazione. L'opera apre un percorso per creare vita, compositi funzionali organico-inorganici con caratteristiche adattive e autoriparanti con applicazioni in biomedicina, medicina rigenerativa, e biorisanamento.
© 2020 Scienza X Rete