Fig.1 Breve panoramica del presente studio. Credito:Università di Osaka
A tutti gli studenti di chimica viene insegnata la tavola periodica, un'organizzazione degli elementi che aiuta a identificare e prevedere le tendenze nelle loro proprietà. Per esempio, gli scrittori di fantascienza a volte descrivono la vita in base all'elemento silicio perché è nella stessa colonna nella tavola periodica del carbonio.
Però, ci sono deviazioni dalle tendenze periodiche previste. Per esempio, piombo e stagno si trovano nella stessa colonna della tavola periodica e quindi dovrebbero avere proprietà simili. Però, mentre le batterie al piombo sono comuni nelle auto, le batterie all'acido di stagno non funzionano. Oggi sappiamo che questo è dovuto al fatto che la maggior parte dell'energia nelle batterie al piombo è attribuibile alla chimica relativistica, ma tale chimica era sconosciuta ai ricercatori che originariamente avevano proposto la tavola periodica.
La chimica relativistica è difficile da studiare negli elementi superpesanti, perché tali elementi sono generalmente prodotti uno alla volta nelle reazioni di fissione nucleare e si deteriorano rapidamente. Tuttavia, avere la capacità di studiare la chimica degli elementi superpesanti potrebbe scoprire nuove applicazioni per gli elementi superpesanti e per i comuni elementi più leggeri, come piombo e oro.
In un recente studio in Chimica della natura , i ricercatori dell'Università di Osaka hanno studiato come i singoli atomi del metallo superpesante rutherfordio reagiscono con due classi di basi comuni. Tali esperimenti aiuteranno i ricercatori a utilizzare i principi relativistici per utilizzare meglio la chimica di molti elementi.
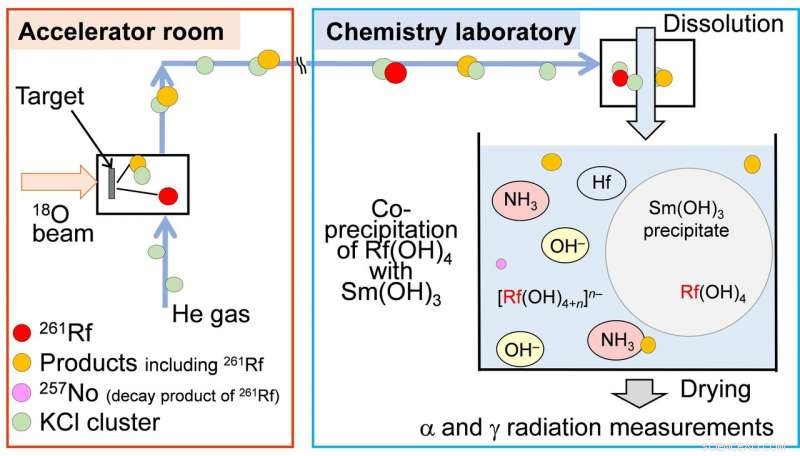
Fig.2 Diagramma schematico dell'esperimento di coprecipitazione online di 261 rf. (credito:Università di Osaka
"Abbiamo preparato singoli atomi di rutherfordio presso la struttura di ricerca dell'acceleratore RIKEN, e ha tentato di far reagire questi atomi con basi idrossidi o basi amminiche, " spiega Yoshitaka Kasamatsu, autore principale dello studio. "Le misurazioni della radioattività hanno indicato il risultato finale".
I ricercatori possono comprendere meglio la chimica relativistica da tali esperimenti. Per esempio, rutherfordio forma composti precipitati con base idrossido a tutte le concentrazioni di base, eppure i suoi omologhi zirconio e afnio in alte concentrazioni. Questa differenza di reattività può essere attribuita alla chimica relativistica.
"Se avessimo un modo per produrre un precipitato di rutherfordio puro in quantità maggiori, potremmo andare avanti proponendo applicazioni pratiche, ", afferma l'autore senior Atsushi Shinohara. "Nel frattempo, i nostri studi aiuteranno i ricercatori a esplorare sistematicamente la chimica degli elementi superpesanti".
La chimica relativistica spiega perché il metallo d'oro sfuso non è color argento, come ci si aspetterebbe in base alle previsioni della tavola periodica. Tale chimica spiega anche perché il metallo di mercurio è un liquido a temperatura ambiente, nonostante le previsioni della tavola periodica. Potrebbero esserci molte applicazioni impreviste che derivano dall'apprendimento della chimica degli elementi superpesanti. Queste scoperte dipenderanno dai protocolli appena riportati e dagli studi fondamentali in corso come questo dei ricercatori dell'Università di Osaka.